根据国家相关法律法规要求,药品上市许可持有人(申请人)应当主动开展药品上市后研究,实现药品全生命周期管理。鼓励持有人运用新生产技术、新方法、新设备、新科技成果,不断改进和优化生产工艺,持续提高药品质量,提升药品安全性、有效性和质量可控性。但药品上市后变更不得对药品的安全性、有效性和质量可控性产生不良影响。

药品某一项变更往往不是独立发生的,一项变更伴随或引发其他变更称之为关联变更。由于这些变更对药品安全性、有效性和质量可控性影响程度可能不同,研究工作总体上应按照技术要求较高的变更类别进行,同时建议关注多项关联变更对药品安全性、有效性和质量可控性产生的叠加影响。
变更分类
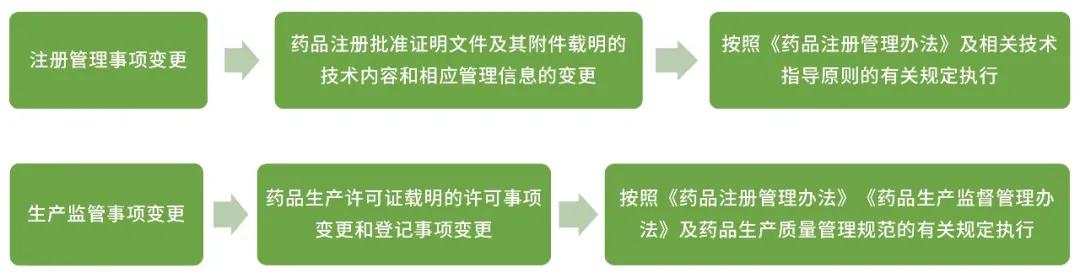
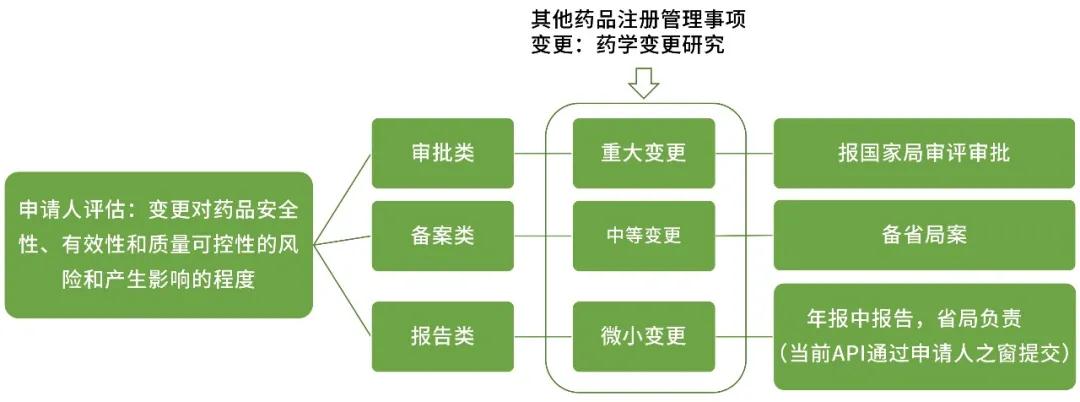
药品上市后变更包括注册管理事项变更和生产监管事项变更,也就是涉及注册批件和生产许可证相关事项的变更。依据变更对药品安全性、有效性和质量可控性的风险和产生影响的程度,将变更划分为审评类变更、备案类变更和报告类变更。
根据不同时间阶段分类
上市后变更:参照《药品上市后变更管理办法(试行)》《已上市化学药品药学变更研究技术指导原则(试行)》进行研究。
审评期间变更:参照《药品注册申请审评期间变更工作程序》,审评期间允许进行变更申请,这也是近期变更研究的热门话题,审评期间的变更需要注意以下方面:不影响产品质量;仅能提出一次;参照已上市药品变更相关指导原则研究及申请;时限按变更/原申报剩余时间最长计算;审评期间的变更以补充申请报国家药监局药审中心(CDE)。
状态为I,未进入审评的原料药变更:可参照已上市药品变更研究,当前原料药受理后即视为启动审评,暂时没有途径递交资料,后续CDE应该会有新的政策。
根据变更对药品的影响程度分类
依据变更对药品安全性、有效性、质量可控性的影响,将药学变更分为微小变更、中等变更和重大变更,由申请人依据对产品的理解进行评估及相应的研究、申报工作。
变更研究
微小变更
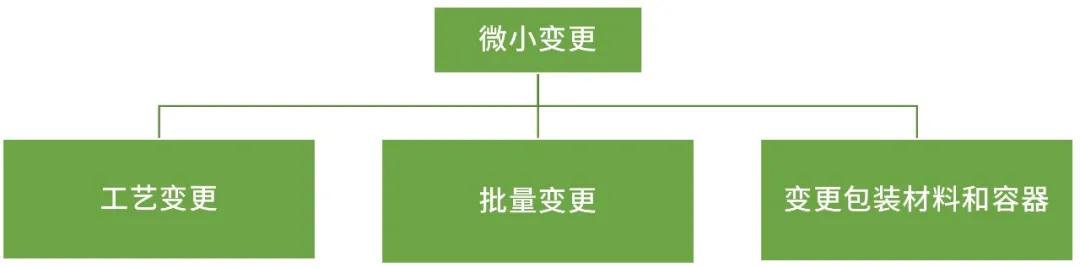
工艺变更:增加/收严过程控制;提高起始原料、中间体的质量标准;变更试剂、溶剂的质量标准或级别,但不降低质量;变更最后一步反应之前生产设备;变更最后一步生产设备,且材质、设计和工作原理不变,原料药关键质量不变;变更起始原料的供应商,起始原料的合成路线不变,且起始原料的质量不降低。
研究内容:变更情况及原因;一批样品检验;年报中报告首批样品的长期稳定性试验数据。
批量变更:生产批量变更在原批准批量的10倍以内(包括10倍)
研究内容:设备对比;一批批生产记录;变更前后质量对比研究;对1-3批样品进行检验。
变更包装材料和容器:变更原料药装量;固体原料药的包材(包材为A)。
研究内容:变更前后包材对比。
中等变更
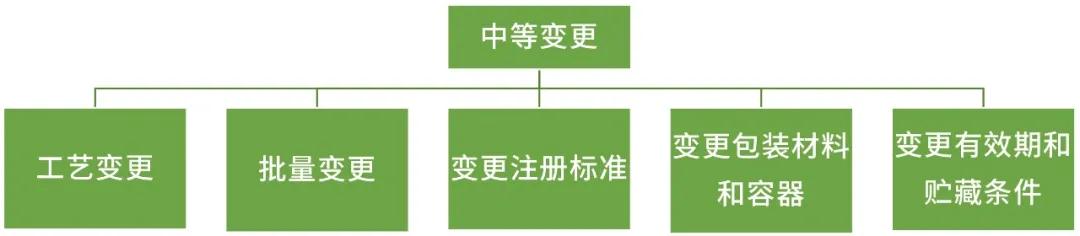
工艺变更:延长工艺路线,且延长的工艺路线与原起始原料一致;变更起始原料的合成路线,起始原料的质量不降低;变更最后一步反应之前的工艺步骤中的反应试剂、溶剂种类、生产条件等,但原料药杂质谱保持一致;将返工工艺作为固定的生产步骤纳入注册生产工艺;变更起始原料、中间体的质量标准,变更后起始原料、中间体的质量控制水平不得降低;变更起始原料的供应商,起始原料的合成路线不变,且起始原料的质量不降低;无菌原料药变更除菌过滤过程的滤过参数/除菌工艺过滤器从单一过滤器改为两个无菌级过滤器串联。
研究内容:变更情况及原因;一批批生产记录;质量对比研究,变更前后样品的杂质谱等一致;1-3批样品进行检验;一批样品加速及长期稳定性考察,提供3个月的稳定性研究资料。
批量变更:生产批量变更在原批准批量的10倍以上。
研究内容:设备及工艺对比。
变更注册标准:新增检验项目;在原标准规定范围内收紧限度;注册标准中文字描述的变更。
研究内容:对质量标准变更合理性进行研究;不用提供生产记录及稳定性数据;多批次检测数据。
变更包装材料和容器:无菌和/或液体原料药的包装材料和容器的材质和/或类型。
研究内容:变更前后包材对比;进行包装工艺验证(不要求全工艺验证)。
变更有效期和贮藏条件:延长药品有效期;缩短药品有效期。
研究内容:变更情况及原因;3批样品长期稳定性数据。
重大变更
工艺变更:变更原料药合成路线(除路线延长);变更起始原料的合成路线,起始原料的质量发生变化;变更最后一步反应及之后的生产工艺;变更可能影响原料药关键质量属性的工艺参数;在注册生产工艺中增加重新加工工艺;放宽或删除已批准的起始原料、中间体质量控制和生产过程控制;变更原料药生产工艺中的设备,可能导致原料药杂质谱或关键理化性质发生变化;无菌原料药生产过程变更灭菌/无菌工艺,变更除菌过滤器孔径;其他可能导致原料药杂质谱和关键理化性质与变更前不一致的变更。
研究内容:变更情况及原因;变更后的API和中间体结构确证;一批批生产记录;质量对比研究;3批样品检验;3批样品加速及长期稳定性考察,3-6个月的稳定性对比研究。
变更注册标准:变更检验方法;放宽控制限度;删除注册标准中的任何项目。
研究内容:对质量标准变更合理性进行研究;3批样品检测数据;
变更包装材料和容器:变更为全新材料、全新结构、风险度提高的新用途的包装材料和容器;变更纳入登记管理的包装材料和容器,变更后的包装材料和容器尚未登记或登记状态为I。
研究内容:变更前后包材对比;进行包装工艺验证(不要求全工艺验证)。
变更有效期和贮藏条件:变更药品贮藏条件;由于药品的其他变更导致的有效期变更。
研究内容:变更情况及原因;按方案,3批样品稳定性,3-6月数据。
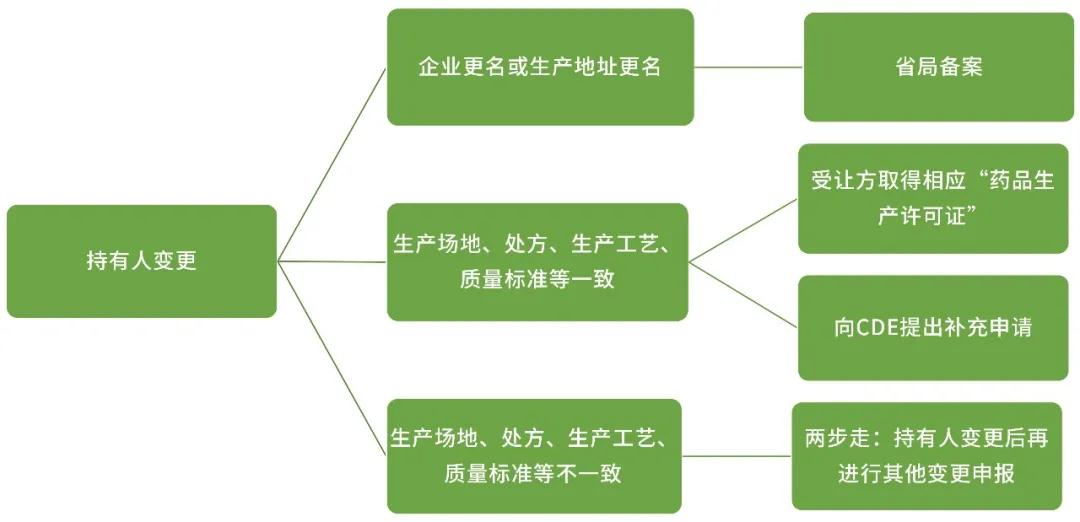
除以上变更外,《药品上市后变更管理办法(试行)》及《已上市化学药品药学变更研究技术指导原则(试行)》对持有人及生产场地的变更流程及研究内容进行了明确的规定。
持有人变更
生产场地变更
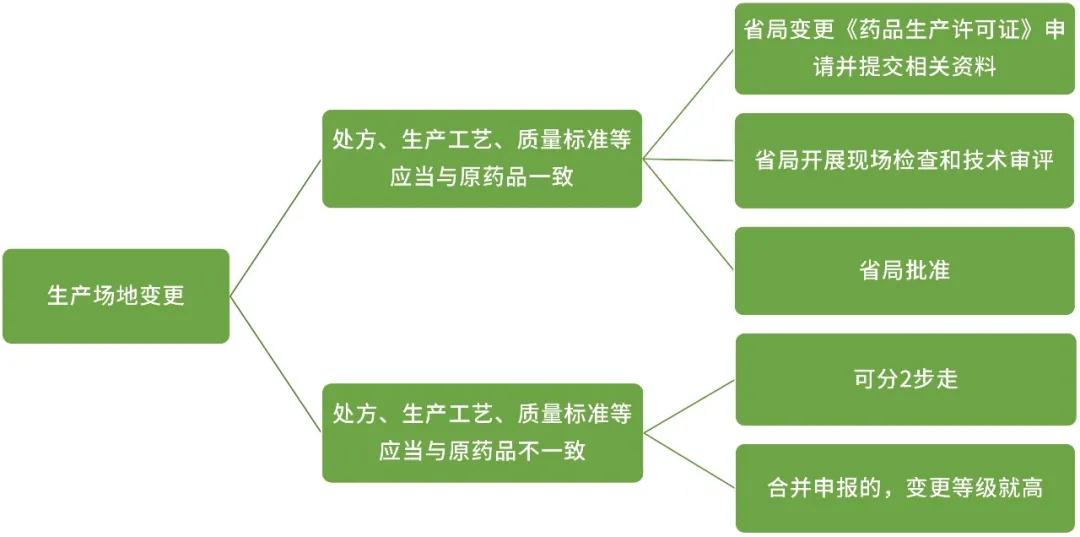
在同一生产地址内变更非无菌生产步骤:
研究内容:变更的具体情况和原因;比较新旧场地生产工艺情况(含设备和工艺);对变更后一批样品进行检验,应符合质量标准规定;对变更后首批样品进行长期稳定性考察,并在年报中报告。
上报:省局
在同一生产地址内变更无菌步骤或生产地址变更至另一不同生产地址:
研究内容:变更的具体情况和原因,进行验证;比较新旧场地生产工艺情况(含设备和工艺);变更后一批样品的批生产记录;进行质量对比研究,关键理化性质和 杂质谱等应保持一致;对变更后3批样品进行检验;变更后一批样品进行加速及长期稳定性考察,提供3个月的稳定性研究资料,并与变更前产品比较,变更后样品的稳定性应不低于变更前。
上报:省局
案例分享
案例:某原料药,由于起始原料供应商不再供货,对生产工艺的进一步研究及制剂对原料药质量要求的提高,拟进行一系列变更。
起始原料变更:

工艺优化:

T项目注册标准变更:

解析:该案例项目涉及一系列变更,有属于微小变更的改变后处理溶剂,中等变更的收严限度,重大变更的变更最后一步反应参数等,依据 《已上市化学药品药学变更研究技术指导原则(试行)》,按照技术要求较高的类别进行研究,故本品按重大变更进行研究,报补充申请,并依据具体变更内容进行针对性研究。需要研究内容如下:
对变更前后的路线进行详细的对比说明;
对变更前后的起始物料、中间体、原料药进行对比研究;
进行工艺参数评估,拟定合理参数范围;
对变更后生产的原料药进行结构确证;
进行3批工艺验证,对所得中间体和原料药进行全面分析研究,提供3批检测报告;
对变更后3批样品进行加速及长期稳定性考察,提供3-6个月的稳定性研究资料;
变更流程及时限

备注:自备案完成之日起30日内完成对备案资料的审查,必要时可实施检查与检验;审批类变更的补充申请审评时限为60日;补充申请合并申报事项的,审评时限为80日;其中涉及临床试验研究数据审查、药品注册核查检验的审评时限为200日。