近日,来自瑞士的一家生物技术公司ADC Therapeutics宣布,美国FDA已批准该公司靶向CD19的抗体偶联药物Zynlonta(loncastuximab tesirine-lpyl)上市,作为单药治疗已接受过2种或多种系统疗法的复发/难治性大B细胞淋巴瘤成人患者。新闻稿指出,这是首款获得FDA批准靶向CD19的抗体偶联药物。值得一提的是,由高瓴资本支持的瓴路药业(Overland Pharmaceuticals),通过与ADC Therapeutics公司成立合资公司Overland ADCT BioPharma,取得ADC Therapeutics的独家授权,并已获得国家药监局批准Zynlonta临床试验。
目前全球已有12款ADC药物获批上市,其中7款用于治疗血液系统肿瘤,5款用于治疗实体瘤。据有关预测,全球已上市ADC药物的市场规模到2026年可达164亿美元。
ADC药物是采用特定的化学连接将抗体和小分子细胞毒药物连接起来,其主要组成成分包括抗体、Linker化学连接和小分子细胞毒药物(smallmolecular cytotoxic drug,SM)。抗体分子主要发挥靶向投递作用,Linker通过化学共价作用将抗体和小分子药物结合起来,小分子药物发挥效应。和融合蛋白相比,ADC药物具有更高的耐受性或较低的副作用。ADC药物对靶点的准确识别性以及对非癌细胞没有影响,极大地提高药效并减少毒副作用,备受药品研发人员的关注。
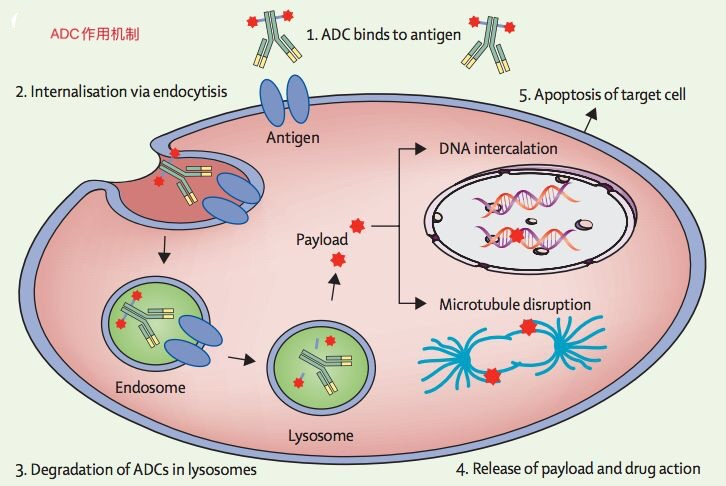
图片:ADC药物的作用机制示意图
细胞毒性药物通常是扰乱细胞DNA合成或者扰乱微管合成的化疗药物,具有非常高的毒性,而且具备与连接子Linker结合的位点。连接单克隆抗体和化疗药物的连接子在ADC的安全性和效力方面也具有关键性作用,它们需要在血液循环中保持稳定,尽量减少细胞毒性药物在非肿瘤组织中的释放,但是在靶向肿瘤内部能够有效释放药物。当ADC与癌细胞表面表达的抗原结合后,它通过内吞过程被癌细胞吞入细胞内部,连接子可以在内体(endosome)或溶酶体(lysosome)中被切断,释放出细胞毒性药物抑制微管的合成或者导致DNA复制错误,从而引发癌细胞的凋亡。
ADC药物的靶点、抗体、连接子、毒素分子及偶联方式是非常重要的几个部分。ADC药物的靶向性来自于抗体部分(Antibody),毒性来自于毒素分子(Payload),两者通过连接子(Linker)相连接,连接子决定了药物的稳定性。因此,ADC技术的进步与抗体、连接子、细胞毒素分子及偶联方式的发展紧密相关。
靶点选择 (Antibody)
ADC药物目前主要应用于肿瘤领域,因此首先要求抗原靶标能够在肿瘤细胞内高表达,而在正常细胞组织中低表达或者不表达,或仅在特定组织类型中有表达。其次,目标抗原应该存在于细胞表面,以便循环的抗体mAb可以进入,同时抗原靶标应具有一定的内吞能力,触发ADC-抗原复合物转运到细胞内,而肿瘤细胞表面抗原数量通常有限,抗原-抗体复合物的内化过程通常效率低下,所以靶点的选择具有一定挑战性。
抗体选择
高特异性和高亲和力是ADC药物中抗体应具有的主要特征,此外抗体还应具有低免疫原性、低交叉反应性、适当的连接结合特性。目前所有的ADC抗体都是IgG分子,因其对靶点抗原的高亲和力和在血液中有较长的半衰期。
毒素分子(Payload)
毒素分子是决定ADC杀伤力的关键因素,除需具有极高的毒性外,还需具有足够的水溶性及血清中的稳定性,目前使用的主要是微管抑制剂和DNA损伤剂。
连接子(Linker)
连接子是ADC有效递送细胞毒性药物的基础,连接子必须在血液循环中保持稳定,在进入肿瘤细胞时能够快速释放有效细胞毒药物以杀死癌细胞。
偶联方法
偶联方法主要分为非定点偶联和定点偶联。目前常用的定点偶联方式是通过基因工程位点进行特异性偶联,以实现更均一的ADC,能在特定位点实现细胞毒素的连接。
大多数ADC药物由靶向特定肿瘤相关抗原的单克隆抗体(mAb)和附着于该抗体上的细胞毒性药物构成。ADC药物将单抗的靶向递送优点与有效负荷剂量细胞毒性药物肿瘤杀伤作用相结合,从而克服了细胞毒性药物毒性大,不适合系统给药的缺点。

图片:已经获得美国FDA批准上市的ADC药物
数据来源:美国FDA官网
国内在研15款ADC产品靶点扎堆HER2
ADC药物的研究可以追溯到1980年,但是直到2000年,美国FDA才批准辉瑞(Pfizer)公司的Mylotarg(gemtuzumab ozogamicin)在美国上市,成为第一款ADC药物,用于治疗急性粒细胞白血病,但由于其产生致死性的毒性,于2010年撤市。随着技术的改进,研究人员开发了新型抗体偶联药物,并于2011年经FDA批准用于治疗霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤。2013年抗体偶联药物再次取得突破,Genentech/ImmunoGen联合开发的Ado-trastuzumabemtansine被FDA批准用于HER2阳性乳腺癌,这是首个针对实体瘤的ADC药物。随着这两个药物的研发成功,ADC药物再次以火热的状态进入人们的研究视野。
目前国内暂无国产ADC药物获批上市,荣昌生物的纬迪西妥单抗是国内首个提交新药上市申请的自主研发的ADC药物,用于治疗局部晚期或转移性胃癌,另有多家企业的ADC药物正处于临床或IND申请阶段。
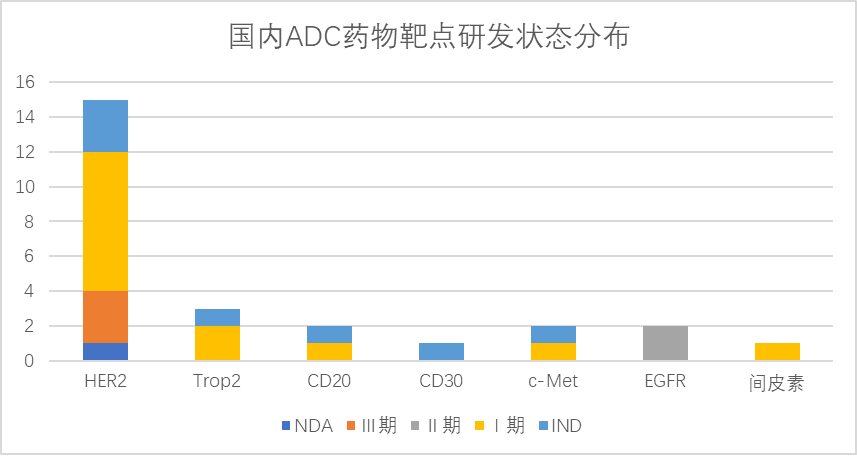
图片:国内ADC药物靶点研发状态分布
数据来源:各药企官网
相比于国外药企丰富的靶点布局,国内有15款ADC产品靶点为HER2,可见HER2已成为国内药企ADC药物的一个扎堆开发的靶点,竞争十分激烈。百奥泰研发的注射用BAT8001、东曜药业的注射用TAA013,浙江医药的ARX788均已进入临床III期,靶点都是HER2,针对的适应症都是乳腺癌,除EGFR—ADC进入II期外,Trop2、EGFR、CD20、c-Met、间皮素最高进展均为临床I期。
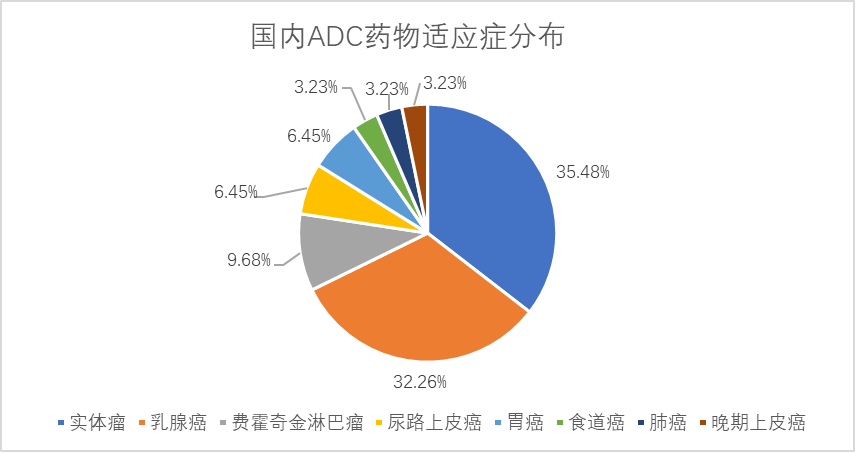
图片:国内ADC药物适应症分布
数据来源:各药企官网
和国外适应症集中度类似,国内ADC药物的开发也聚焦在肿瘤领域,尤其是乳腺癌等实体瘤。荣昌生物的RC48拥有丰富的在研适应症,除针对局部晚期或转移性胃癌已提交上市申请外,乳腺癌、尿路上皮癌、胆道癌、非小细胞肺癌等适应症都已推进到临床进程中。
由于技术发展受限,ADC行业发展前景一度不被看好,但随着核心技术的更新迭代、近年来一些ADC药物的接连获批、以及在治疗上展示出的巨大优势,该领域正逐渐受到全球制药公司的关注。我国ADC药物研究起步晚,研发靶点单一,HER2领域竞争激烈,主要针对乳腺癌。对于新进入者而言,差异化的靶点及适应症布局有助于拓展更广阔的市场,如可以拓展到国外比较成熟的CD33、CD19、CD79b、BCMA、Nectin-4等靶点及针对的适应症。除了靶点和适应症创新外,也可以借鉴国外ADC新型技术,如偶联技术、新型细胞毒素、药物负载提升等,来增加企业产品的创新及优化。ADC药物与单抗一样,有其平台属性,随着靶点、毒素、偶联等技术的提升,可以扩展研发管线及疾病领域,有先进技术的企业在未来市场上将更具竞争优势。