近年来,由于活性药物成分(API,原料药)生产技术的进步、生物制药行业的发展、原研药独占权到期、人口日益老龄化以及全球范围内心血管疾病、糖尿病和恶性肿瘤等慢性疾病的患病率不断上升导致对药品的需求日益增长,全球API市场出现快速增长势头。特别是在某些特定区域,如亚洲,API市场始终处于增长状态。预计到2026年,全球API市场规模将达到2,900亿美元。
未来5年API外销型生产商或将快速增长
由于疫情的影响,药品生产速度放缓、供应短缺,基本药物价格上涨,从短期来看,相较于2019年1,750亿美元的API市场规模,2020年预计有所下降,为1,630亿美元,年复合增长率(CAGR)为-6.2%。
2018年和2019年,化学合成类API市场份额连续刷新历史高值,潜在原因是全球原料药供应充足,同时生物技术行业增长速度和市场规模增长均创下历史新高。这种强劲增长势头可能与市场对生物制药产品需求增加、生产工艺技术进步以及这些药品疗效增加有关。
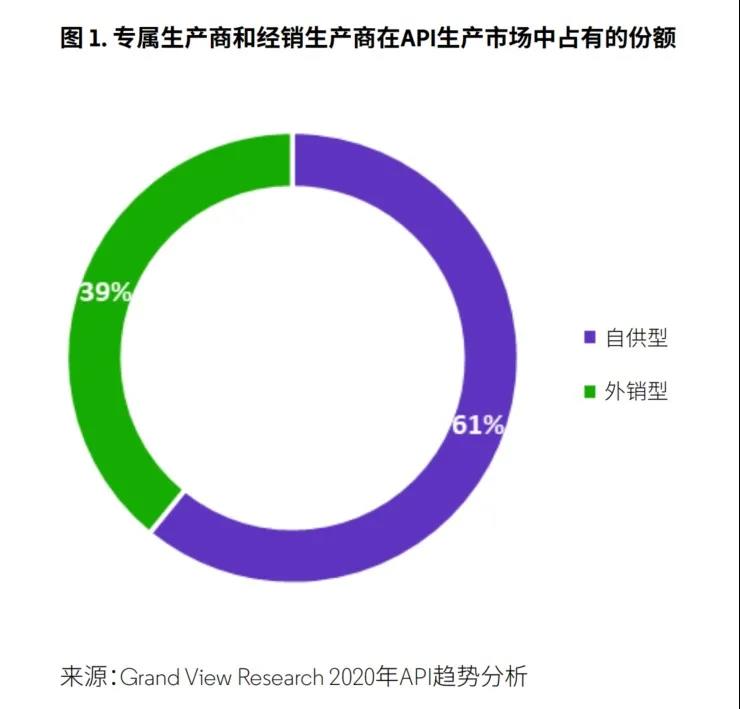
在生产商类型方面,API自供型生产商(原料药制剂一体化制药公司)的市场份额远高于API外销型生产商(图1),但预计在未来5年内,API外销型生产商将进入快速增长期。导致此类公司快速增长的原因是自供生产原料药成本较高以及市场对生物制药的需求增加。
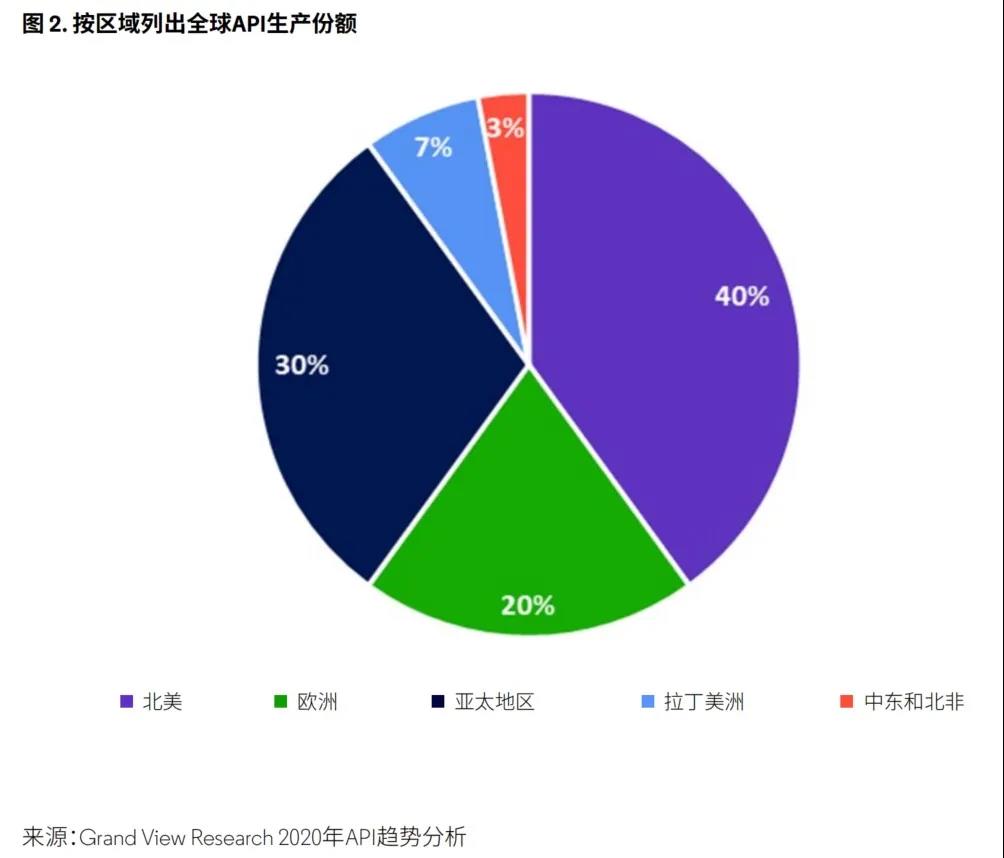
按不同区域划分,2018年和2019年北美占据最多的全球市场份额(图2),预计未来几年该区域将继续保持领先。可观的经济发展速度、技术进步以及恶性肿瘤和与生活方式相关的疾病患病率的逐年攀升,对北美保持这一领先地位起到了推动作用。
中印成熟和较成熟API企业大幅增加
全球有3,200多家公司从事API生产活动。本文根据这些公司向规范市场供应原料药的能力,对其进行了评级。对处于不同发展阶段的生产商的相对规模和能力进行比较,获得有价值的测定基准,以识别出那些有可能创造价值的策略。
数据显示,样本企业中有55%为本土公司,专注于向本地和非规范市场供应API(图3)。
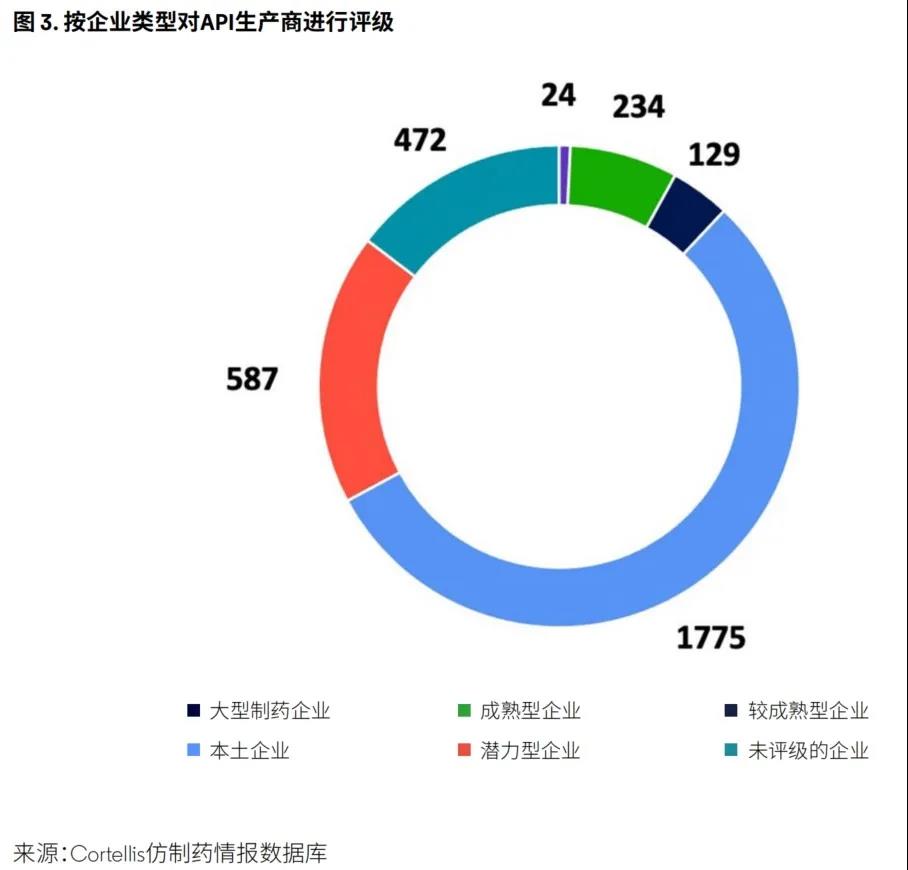
将各类型公司数量的差异程度作为衡量未来竞争潜力的一项指标,可将这些指标作为衡量新兴公司(评级为较成熟型企业和潜力型企业)增长情况的指南,并向目前市场领军企业(评级为成熟型企业的公司)发出信号,对其在未来几年可能面临竞争的激烈程度进行预警。
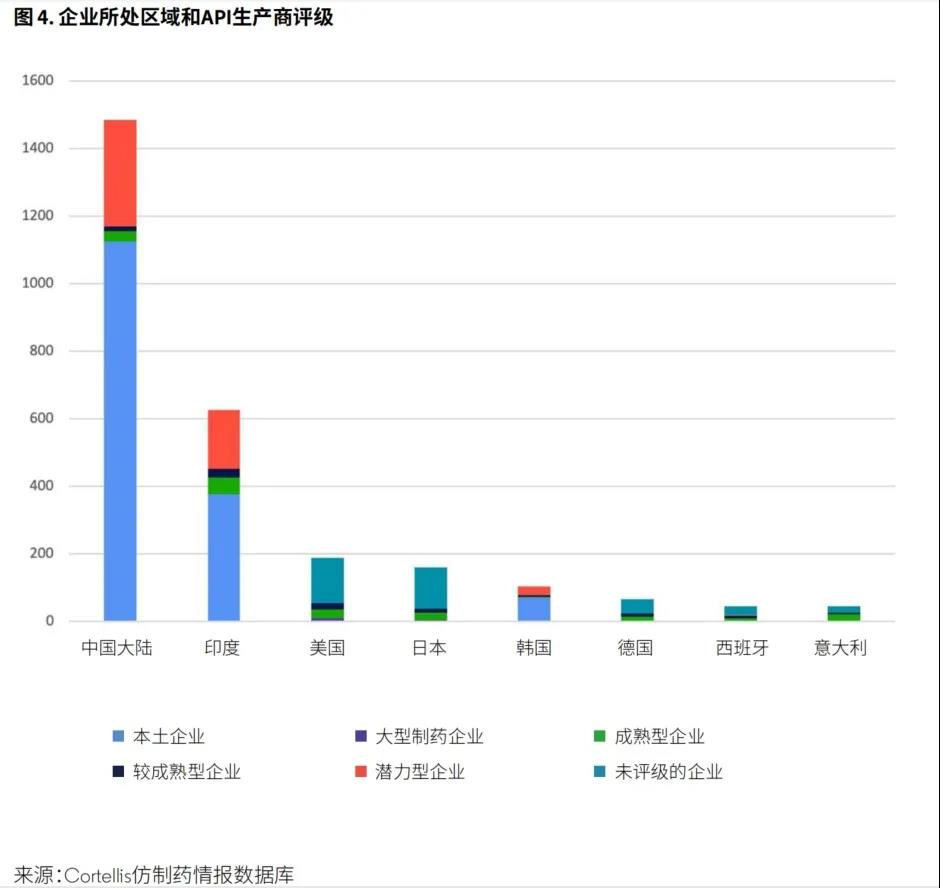
按不同国家和地区划分,拥有API生产商数量排名前五位的国家分别是中国、印度、美国、日本和韩国(图4)。虽然中国的API生产商在数量上占优势,但大多数仅被评为“本土企业”。同样,印度68%的API生产商仅向本地市场供应。然而,随着这些公司不断扩张、投资和向规范市场供应API,他们将有可能向供应链的上游移动。新兴企业正在力图缩小与领军企业之间的差距,预计在多个产品市场上将出现更多的竞争者。
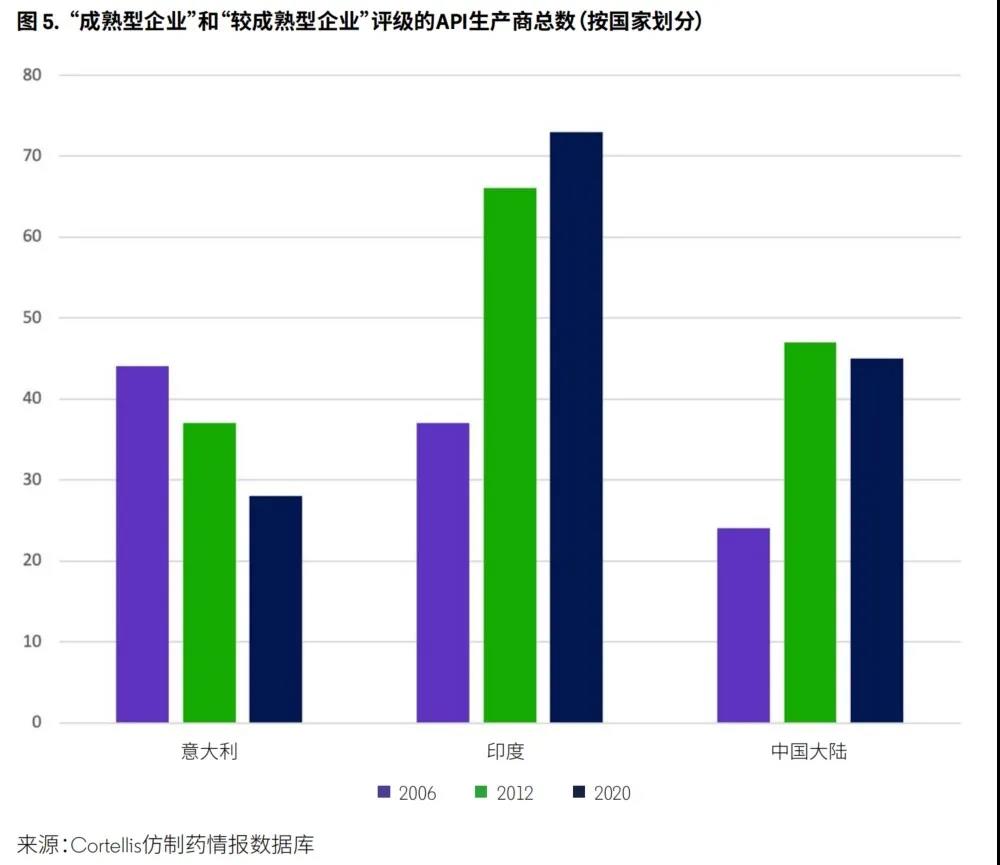
印度和中国的成熟型和较成熟型API企业数量均出现了大幅增加(图5)。意大利API企业数量减少可归因于一些知名并购案,如CBC Co.,Ltd.于2006年对Procos S.p.A.进行收购;同年,私募股权投资公司Investitori Associati收购了Infa Labochim S.p.A.和 Sifavitor S.r.L.这两家API生产商;2007年,德国公司Fresenius Kabi收购了意大利公司Ribbon S.r.L.;2008年,Ergon Capital Partners II SA收购了Farmabios SpA.的全部股本;2013年,Strides Arcolab收购了Disapa S.p.A.。
印度在年度美国药物主文件(DMF)申报数量方面继续领先;中国API生产商提交的DMF数量在过去10年中增加了超过一倍(图6)。
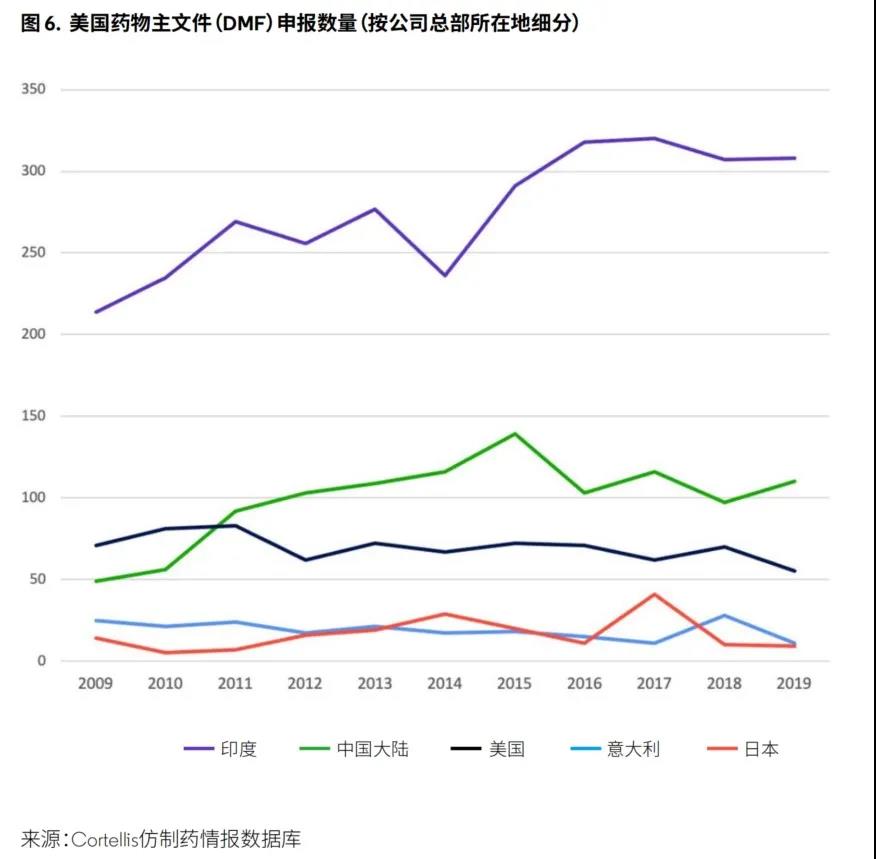
美国DMF应向美国FDA证明API的质量、安全性和有效性,以支持产品的新药上市申请(NDA)、简化新药申请(ANDA)、生物制品上市申请(BLA)和上市前批准。FDA表示,这些企业“应提供关于人用药品生产、加工、包装和储存过程中所使用的设施、工艺或物料的机密和详细信息以及毒理学信息和共享的风险评估和缓解措施等信息”。同时,印度和中国的公司应表明他们将专注于对美国市场进行供应。
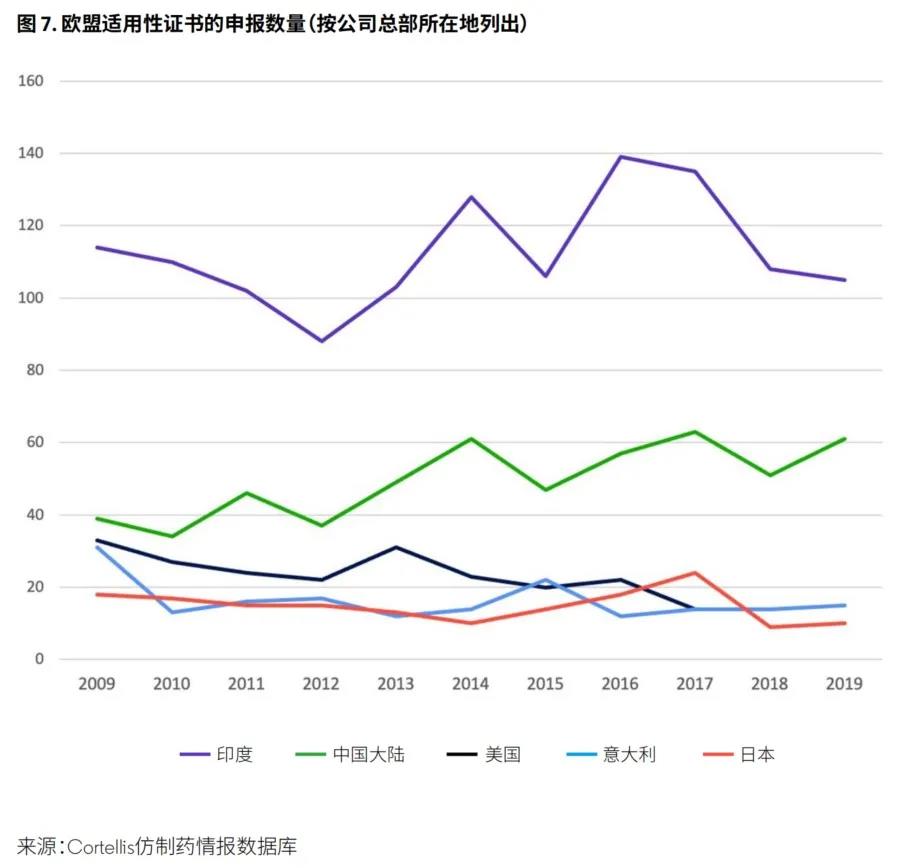
需要从欧盟获得的此类认证为欧洲药典适用性认证(COS/CEP)。在这方面,尽管中国API生产商自2009年以来申报的COS认证数量大幅增加,但印度生产商仍保持领先地位(图7)。有趣的是,向美国、德国和意大利申请此类认证的数量在同一时期均有所下降。这也表明,API生产商将欧洲国家和其他接受CEP认证的国家(例如澳大利亚、加拿大和泰国)作为相对重要的市场。
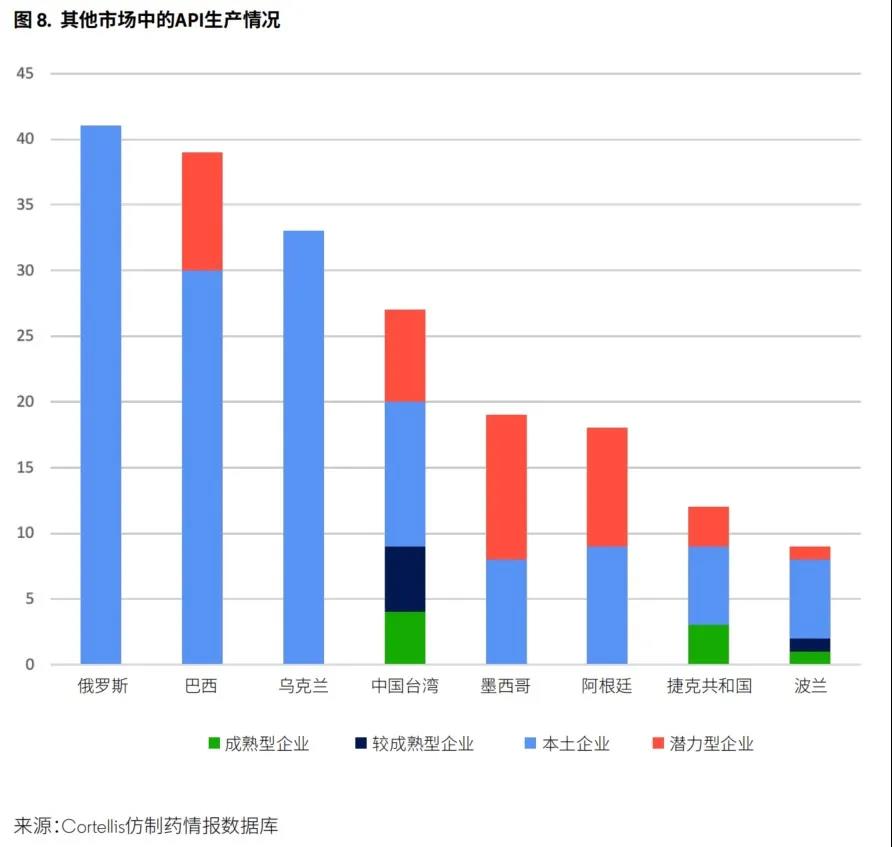
值得注意的是,有许多API备选供应商位于其他国家和地区(图8)。在这些国家和地区,大多数公司均供应当地市场,几乎没有迹象表明API采购将发生重大调整。
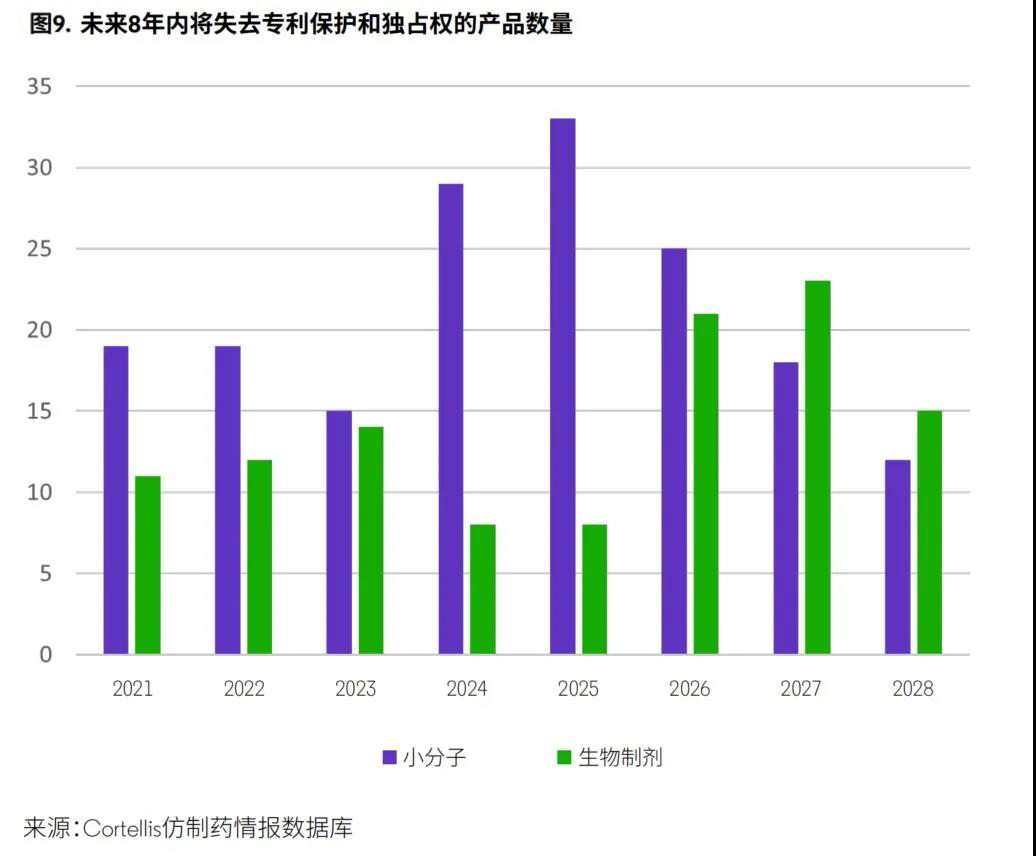
美国市场独占权到 。
在美国,许多小分子药物和生物制剂的专利保护期和独占权将在未来几年到期(图9)。这意味着,尽管生物技术和小分子药物日益受到青睐,但大分子药物和生物制剂并未失去增长机会。
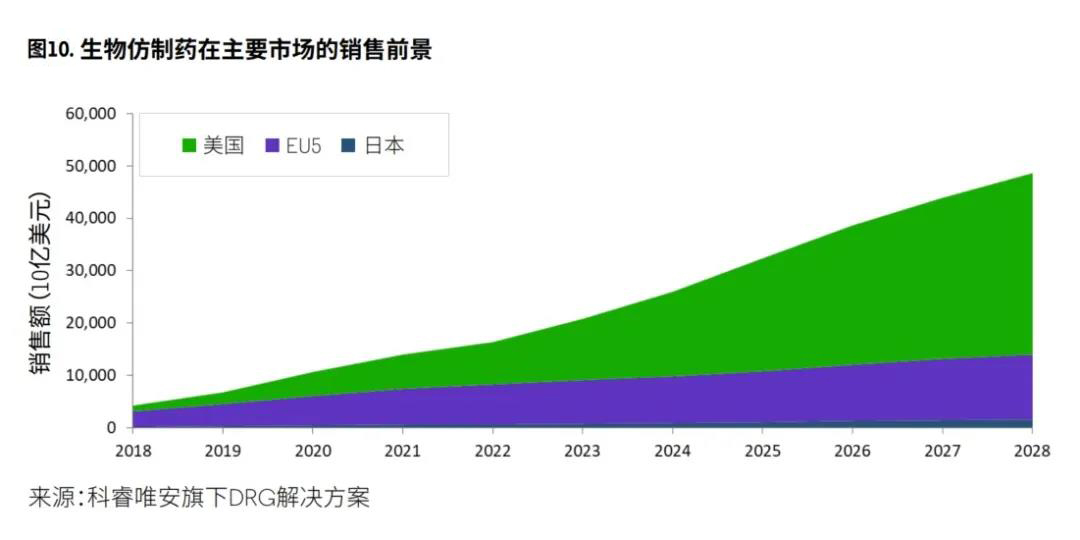
推动生物仿制药市场增长的因素包括生物制剂的“专利悬崖”现象、医疗系统控制医疗成本所面临的压力以及生物制剂分析和生产方面的技术进步。在全球范围内,目前处于研发阶段的生物类似药有400多种,已获批的生物类似药增加了25%。
基于科睿唯安旗下DRG数据分析,预计将有20多种生物制剂参照药可用于生物类似药生产。由于这些参照药目前在所有主要市场中并未面临生物类似药的竞争,预计生物类似药的销售额将从2022年开始出现大幅增加(图10)。
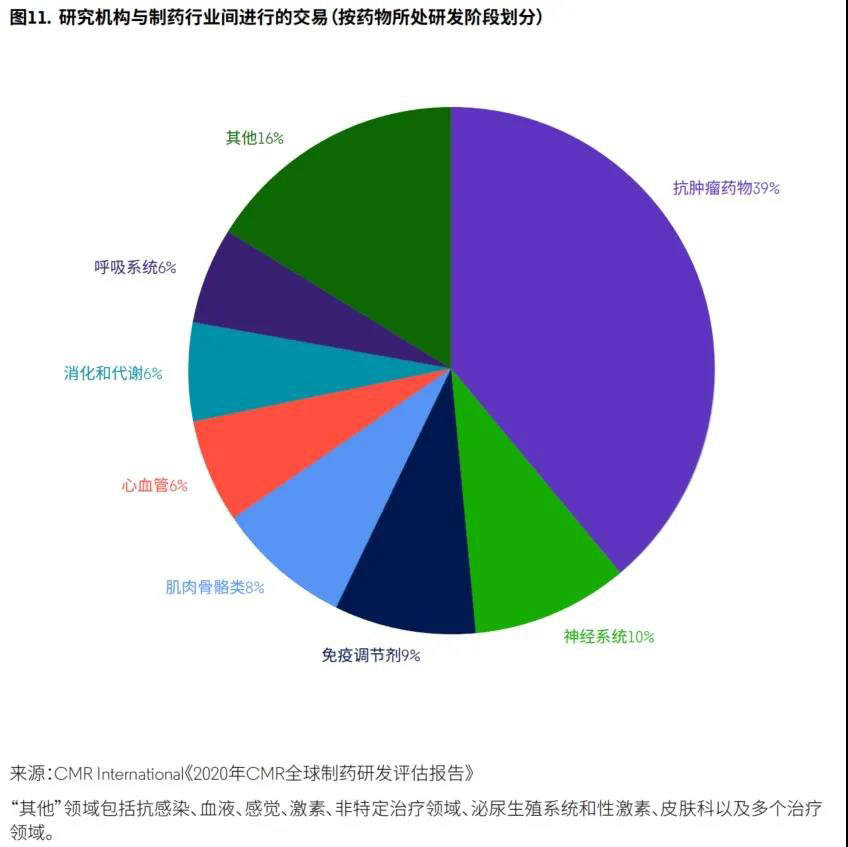
2019年,研发支出排名居前三位的治疗领域为恶性肿瘤、神经系统和免疫调节剂(图11)。据国际药物研究中心(CMR International)《2020年CMR全球制药研发评估报告》,抗肿瘤和免疫调节剂在首次上市的新分子实体(NME)药物中占35%。
同样,大型制药公司进行了大量的收并购活动(表2),许多规模较大的公司均在这一领域进行投资,寻找机会以在这些领域抢占市场份额。
API生产投资趋势
制药公司的投资方向使得API生产状况发生了变化,如继续专注于肿瘤领域以及向专科产品和能力的转变,例如个体化用药、基因疗法和孤儿药。随着这种转变的出现,需要增加新的投资、产生额外的成本、需要更具专业性的原材料以及采取不同的遏制策略。这些变化推动了对专业化生产的持续投资,尤其是对疗效较好的抗肿瘤药物的投资。高活性API(HPAPI)作为靶向治疗药物在肿瘤适应症以及呼吸系统、激素、心血管和中枢神经系统疾病领域中的应用日益增多。就肿瘤领域而言,HPAPI主要包括小分子细胞毒性化合物和抗体药物偶联物(ADC)。
由于这些化合物的毒性较高,需要对厂房采取适当的控制措施和风险管理程序,以确保操作安全、符合严格的监管要求以及避免同一厂房中不同产品相互污染。此外,随着监管机构更多地使用快速审评通道对这些新疗法进行审评,需要快速扩大HPAPI的生产规模,这对于避免产品延迟上市十分重要。因此,许多公司选择将这些产品生产外包。合同生产组织(CMO)以及合同研发生产组织(CDMO)已注意到这种趋势,并正在相应地调整他们的投资策略。
北美
在北美,过去几年中广受关注的收购案如CordenPharma(一家CDMO组织)于2017年收购了辉瑞位于美国科罗拉多州面积达54,000平方英尺的HPAPI生产工厂。该项收购仅是该公司收购策略的一部分,该公司还收购了位于比利时、德国和意大利的肽类和小分子API生产工厂和HPAPI生产工厂。专注小分子API生产的Flamma SpA(一家CDMO组织)于2019年收购了Teva位于宾夕法尼亚州面积达40,000平方英尺的化学合成中心,HPAPI的生产规模可达公斤级,该公司同时还在意大利和中国建立了工厂。
其他公司已投入大量资金用于扩大现有厂房。例如,小分子药物制造公司康伯司于2019年初宣布在美国爱荷华州新建了一个占地6,000平方英尺、造价2,400万美元的HPAPI生产工厂,批量生产规模高达300kg。2019年中,Piramal Pharma Solutions(PPS,一家CDMO组织)在其位于美国密歇根州里弗维尤的工厂侧翼建起了一栋造价1,000万美元的新厂房,专门用于生产HPAPI。仅6个月后,PPS即宣布计划在其位于加拿大的Aurora工厂新建一个造价2,500万加元、占地10,500平方英尺的厂房,专门用于生产API和HPAPI。
大约在同一时间,PCI Pharma Services完成了对其工厂进行的占地30,000平方英尺的厂房扩建,并提高了其在伊利诺伊州的冷链运输能力,以进一步对HPAPI的生产提供支持,用于满足市场需求。2020年下半年,MilliporeSigma宣布其正在对位于美国威斯康星州的工厂(用于生产HPAPI和抗体药物偶联物)的厂房进行扩建和提高产能,扩建后的总面积将达到70,000平方英尺,可实现大规模生产,此举将耗资6,500万美元。
欧洲
在欧洲,API生产商在过去几年中始终聚焦于扩建厂房和提高产能。例如,2018年,Procos SpA在其意大利的工厂开设了一个单元专门用于生产HPAPI,此项举措是该公司耗资7,000万美元实施扩张战略的一部分,该战略已使其产能增加了30%。
2019年,Fareva在其两个欧洲工厂(德国Excella工厂和法国La Vallée工厂)投资了3,400万美元,使其HPAPI产能翻了一倍以上。2019年6月,龙沙集团(一家CDMO组织)宣布对其位于瑞士的工厂进行大面积扩建,以满足市场对HPAPI的需求,同时对阿斯利康产品组合中的产品生产提供支持。Sequens于2020年底在其位于法国的Villeneuve-La-Garenne工厂开设了一个新的单元,用于生产HPAPI。这项耗资3千万欧元的项目被称为UPP30,与比利时生物技术公司Mithra合作开展。
2020年年初,赛诺菲宣布,计划将其API商业化生产和开发活动与其在欧洲的6个API生产工厂(意大利、德国、英国、匈牙利各1个,法国2个)进行组合,旨在成立一家专门为第三方生产和供应API的公司。
亚太地区
2020年第一季度,药明康德子公司合全药业在江苏常州的生产基地新建了一个占地3万平方英尺的寡核苷酸API大型生产车间和一个HPAPI生产车间,这是该公司建立的第二个HPAPI生产车间。
此外,总部位于东京的玻璃和化学品生产商AGC于2019年对其位于日本千叶的厂房进行了扩建,以提高HPAPI的产能。虽然亚太地区的投资活动相对较少,但这并不意味着该区域的公司没有考虑在这些领域进行投资。
连续生产
总体生产能力(如连续生产)的投资也出现增长。这种趋势可部分归因于监管机构逐渐对这种生产方式更加关注,因为这种生产方式所生产出的产品质量和生产效率均优于批量生产。
虽然在过去50多年中,制药公司均采用批量工艺/生产的方式生产药物,但在按顺序进行批量生产的各工序间存在“间歇时间”,这会使对环境敏感的API存在降解风险;此外,多个操作地点也存在引入污染和导致人为错误的风险。
基于连续生产在其他行业中已获得成功并且有被广泛应用的案例,目前制药公司正在采用这种方式作为一种替代性的药物生产。这种生产方式速度更快且更高效,是因其能够在同一车间内不间断地生产,因而消除了间歇时间,同时还可以降低人为错误的概率,确保质量稳定一致;此外,生产人员还可通过灵活调整运行时间对市场变化作出更快反应。因此,美国FDA将连续生产定义为“目前制药行业进行现代化的最重要工具之一”,并推荐制药公司采用这种生产方式。FDA已于近期发布了关于连续生产质量评定的指南草案。在该指南草案中,FDA表示,将对原料药和在NDA、ANDA、DMF和BLA申报资料中申报的所有制剂剂型和无需提交申请的非处方药(OTC)进行连续生产的制药公司提供支持。由于能够实时进行自动化监控和产品质量监控,连续生产也能够符合FDA所倡导的“质量源于设计(QbD)”的要求 。
对于制药公司而言,随着利润逐渐缩减,连续生产可缩减成本、降低风险和缩短研发时间线。连续生产的优势包括:产量高、厂房占地面积小、能耗低、能保持稳定生产、能够灵活控制时间和减少废物的产生。
新冠肺炎疫情的影响
新冠肺炎疫情凸显了仿制药供应链中的漏洞。市场对抗生素、呼吸系统药物和抗病毒药物的需求增加,但与此同时,供应链和生产环节均出现中断问题。在Global Pharma Insights进行的一项调查中,67%的受访者表示,他们的政府正试图将生产工厂迁回国内,以应对疫情造成的供应中断。此外,有84%的受访者表示,他们的公司正在积极寻求新的供应链合作伙伴。
未来,制药公司或将转向更加区域化的多元化供应链,如对本地和全球范围内的供应商进行适当组合,以满足特定市场的需求。与此同时,API生产商或将建立多个生产工厂,以最大限度地减少对收入来源的影响,即如果某一特定区域出现问题,还可以在其他工厂继续生产。