尽管2020年新冠肺炎疫情对制药行业的新药开发计划均造成了较大的影响,但从2020年美国和欧盟批准新药数量来看,两个监管机构药品审批速度丝毫没有放缓。
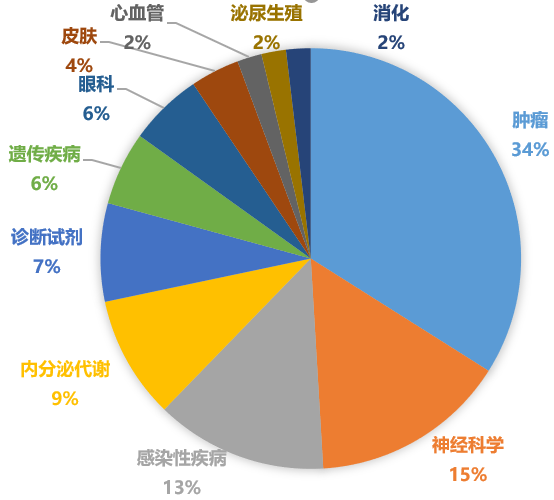
2020年美国FDA批准新药的适应证分布
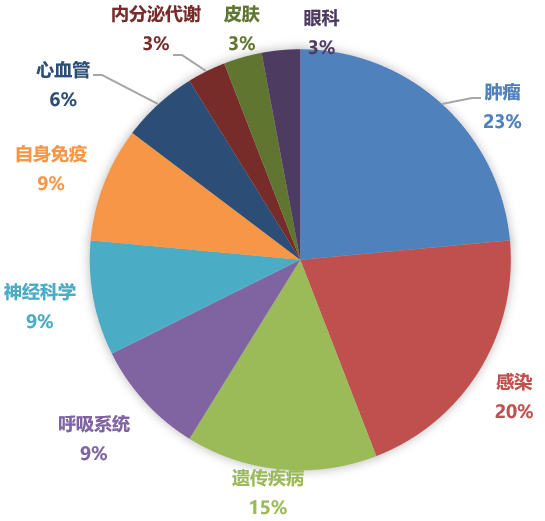
2020年欧盟EMA批准新药的适应证分布
从疾病领域来看,据Pharmadigger数据库统计,2020年FDA批准的新药1/3为肿瘤药,其次是神经科学和感染性疾病等药物;EMA批准的新药情况类似,肿瘤药占主要适应证领域,其次是感染性疾病和遗传疾病。
从批准的时间来看,FDA批准的新药多数为全球首批;而欧盟方面,仅有6个药物为全球首批。一是由于美国新药开发环境更活跃,专注于新药研发的公司数量较多,FDA对于授予孤儿药资格或加速审评等促进新药开发的态度更开放;二是EMA审批流程更复杂,由于EMA的人用药品委员会(CHMP)的成员来自欧盟各国,自2005年11月以来,所有的肿瘤、罕见病、自身免疫、糖尿病的新药和基因疗法必须通过EMA集中审批程序,但随着欧盟的扩大,架构和平均审评耗时不可避免地会比FDA更繁杂。
2020年同时在FDA和EMA获批的新药
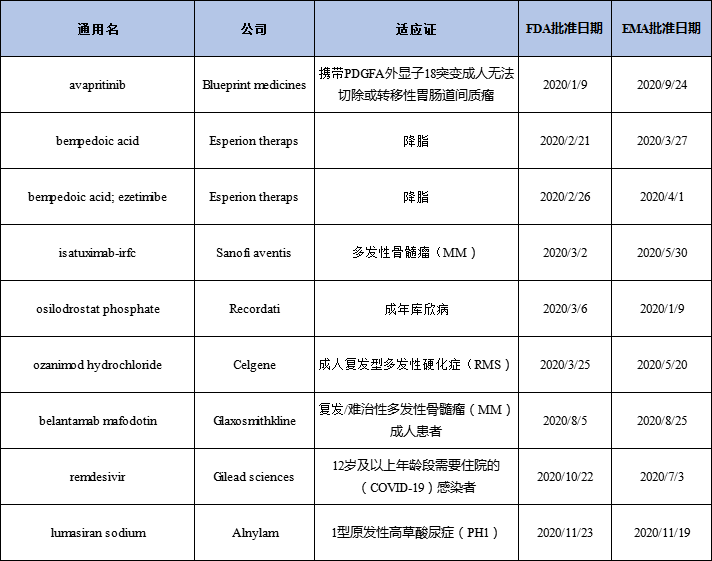
Esperion公司两个口服降胆固醇药物Nexletol(bempedoic acid)和Nexlizet(bempedoic acid and ezetimibe)在美国和欧洲市场获得批准,且销售开局较好
2020年获得过FDA突破性疗法资格授予的新药
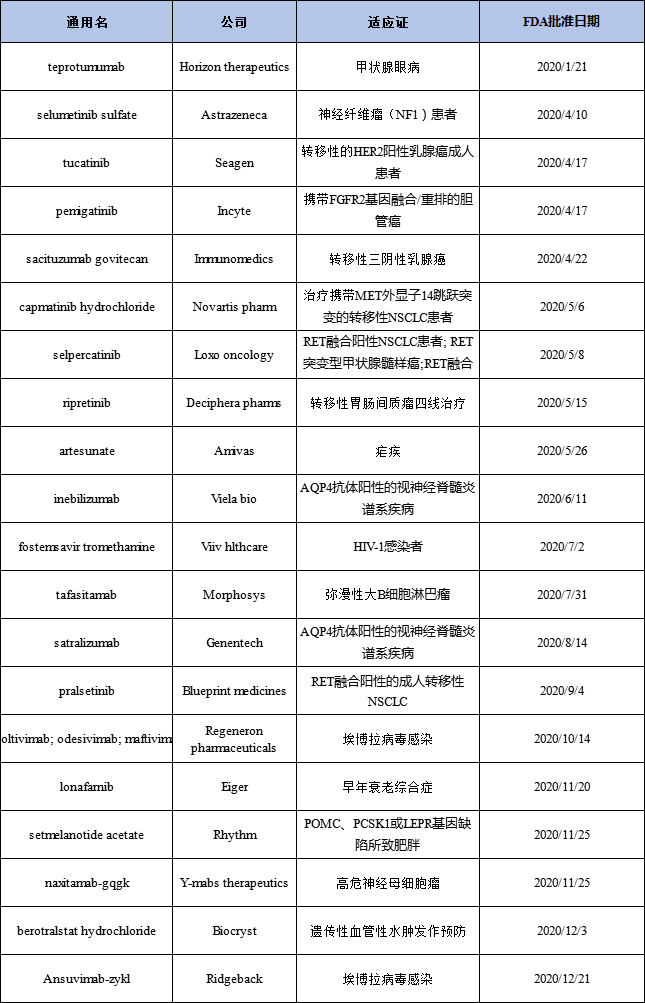
ADC领域整体势头不减。继2019年批准3款ADC药物之后,2020年FDA通过突破性疗法批准2款首个针对靶点的上市药物。Sacituzumab govitecan是第一款上市的靶向Trop-2药物,基于一项纳入108例转移性三阴性乳腺癌患者的单臂临床II期试验结果,总缓解率(ORR)为33.3%,中位缓解持续时间为7.7个月。Belantamab mafodotin是第一款上市的靶向BCMA的药物和ADC,适应证为既往至少经历了4线治疗(包含CD38靶向性抗体)的复发/难治型多发性骨髓瘤,ORR为31%。
首个抗体药物复方制剂Inmazeb于2020年10月14日获批用于埃博拉病毒感染,该制剂由3种单克隆抗体(Atoltivimab + Odesivimab + Maftivimab)组成,三个抗体都具有相似结构,靶向结合于埃博拉病毒表面糖蛋白不同位点,通过阻断病毒的附着侵入、招募免疫细胞以感染细胞为目标来中和病毒。
有些在FDA获批的新药已被中国药企引进,这也大幅提高了国内开发的成功率。如基石药业引进的普拉替尼,于2020年9月4日获批用于RET融合阳性的成人转移性NSCLC;恩华药业从Trevena引进了阿片类药物oliceridine的开发和商业化权益,用于治疗中重度急性疼痛,交易价值约一千万美元。
2020年在EMA全球首批的新药有6个,其中2个在FDA也获得批准,分别为RNAi疗法Lumasiran和osilodrostat,其余4个新药均未在2020年获得FDA批准上市。吉利德的filgotinib2020年8月在FDA的上市申请遭到拒绝,在完全回复函(CRL)中,FDA表示了对200mg剂量filgotinib的整体收益风险状况的担忧,目前FDA表示需要通过对来自于MANTA和MANTA-RAy临床研究的数据以完成上市审评。但该药2020年9月24日在欧盟获批上市。
2020年在EMA全球首批的新药
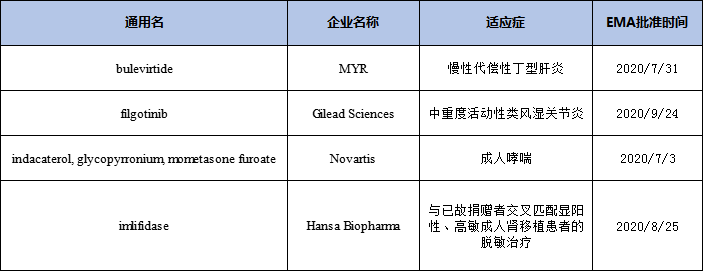
另外两家欧洲公司选择在欧洲先申请新药上市,分别是位于德国专注于开发治疗丁肝病毒感染新药的生物技术公司MYR GmbH,其主打Hepcludex™ (bulevirtide)在2020年7月获得了欧盟的有条件批准上市,用于治疗伴有代偿性肝病的成人慢性丁肝患者,这是全球首个获批用于治疗丁肝的新药。2020年12月10日,吉利德宣布以11.5亿欧元现金收购MYR GmbH。另一家是位于瑞典的致力于开发治疗IgG介导罕见疾病创新疗法的Hansa Biopharma公司,2020年8月获EMA有条件批准其IgG裂解酶Idefirix(imlifidase)上市,用于治疗高致敏肾移植患者,其能快速特异性靶向IgG并抑制IgG介导的免疫应答,在给药后几小时内裂解IgG抗体并抑制其活性。该药曾获欧盟EMA授予的PRIME药品认定。