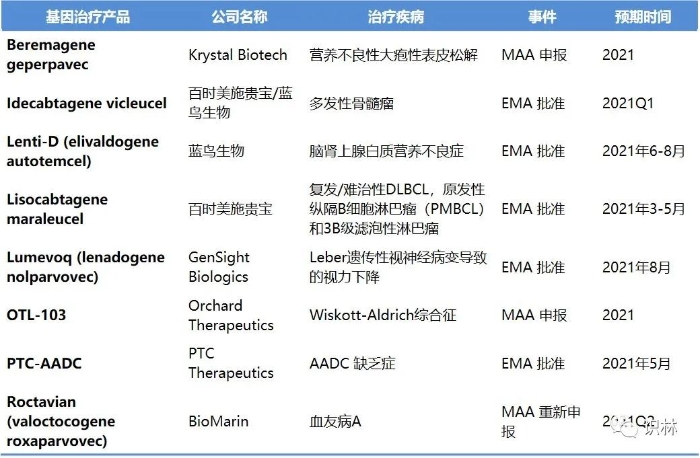
根据对预期上市许可申请申报和批准决定进行分析,预计2021年基因治疗药物在欧盟市场的活动会大大增加。2021年可能会有至少五种基因疗法在欧盟首次批准,至少三种基因疗法提交监管申报(见文末表格)。
2020年,由于新冠肺炎疫情的影响,一些预期本应提交的上市许可申请被推迟,而另一些则面临制造和临床试验方面的障碍。尽管如此,基因疗法仍在全球范围内获得了两个首次批准(此处仅讨论直接施用的基因疗法和基因修饰的细胞疗法,不包括未经基因修饰的细胞疗法)。美国FDA于2020年7月批准了吉利德公司的 Tecartus (brexucabtagene autoleucel),用于复发或难治性套细胞淋巴瘤的CAR-T疗法。2020年12月,欧盟委员会向Orchard Therapeutics公司用于治疗致异色性白细胞营养不良的Libmeldy(编码ARSA基因的自体CD34+细胞)授予完全上市许可。
另外,由于在2016年接受Orchard公司的Strimvelis(自体CD34+富集细胞)治疗患者中发现一例淋巴T细胞淋巴瘤病例,欧盟在2020年下架了该产品。Orchard公司正在调查此病例,认为可能与插入的肿瘤发生有关。Strimvelis被批准用于腺苷脱氨酶缺乏症,到目前为止仅在16名患者身上使用。
根据Pharma projects的报告,目前全球共有14种经批准的基因疗法,包括Libmeldy和Strimvelis。由于欧盟预期监管行动的增加,这一数字可能会在2021年有所增加。
预计蓝鸟生物(Bluebird Bio)公司的两个药物将会获得批准。Lenti-D (elivaldogene autotemcel)是一种用于脑肾上腺皮质营养不良的离体转基因细胞疗法,可能成为蓝鸟生物继2019年6月获得附条件批准上市许可的Zynteglo(betibeglogene autotemcel;编码βA-T87Q-globin基因的自体CD34+细胞)后第二个获批的基因治疗药物。蓝鸟生物公司还计划在2021年年中在美国提交Lenti-D的上市申请。蓝鸟生物与百时美施贵宝合作的 CAR-T idecabtagene vicleucel(ide-cel)也可能会在欧盟获得上市许可。欧洲药品管理局(EMA)一直在加速审评路径下审查针对多发性骨髓瘤靶点BCMA的ide-cel,但可能需要耗时几个月。另外,美国FDA已经将ide-cel的处方药使用者付费计划(PDUFA)行动日期定为2021年3月27日。
Bio Marin公司预计于2021年第二季度重新提交Roctavian(valoctocogene roxaparvovec)的上市许可申请(MAA)。Bio Marin在2020年9月美国证券交易委员会会议中披露,EMA要求公司提供6e13vg/kg(每公斤载体基因组)剂量的III期试验134名患者的完整52周数据。Bio Marin最终于2020年11月撤回了MAA。其在美国也面临着类似的问题,美国FDA在2020年8月的完全回应函中要求其对III期研究后期出血率耐久性进行两年随访。
对于那些几乎没有其它治疗选择且有着迫切需求的患者,基因治疗批准的增加将受到欢迎。预计2021年美国也会出现基因疗法监管申报的增长。美国FDA生物制品审评与研究中心(CBER)主任Peter Marks曾在2020年11月表示,2020年细胞和基因疗法IND申请数量有望超过2019年收到的250件。他还预测,到2030年将推出40至60个产品,治疗超过50万的患者。