药物越来越多 应用越来越广
生物标志物的临床应用
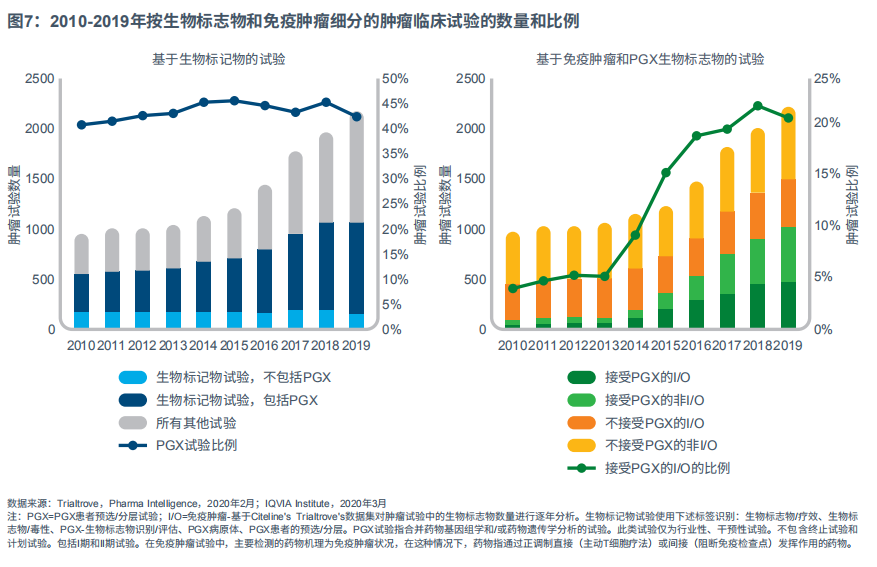
2019年,约一半的肿瘤临床试验包含了药物疗效、毒性或药物基因组(PGX)的患者分层生物标志物。2010~2019年,在基于患者分层生物标志物个体化用药策略的推动下,将生物标志物纳入临床试验以7.7%的CAGR不断上升。
包含PGX患者分层的临床试验(结合药物基因组学和/或药物遗传学分析对患者进行分层,以确定预测疗效、安全性或给药剂量的试验)数量自2010年以来翻了一倍以上,占2019年所有肿瘤药物试验的42%(见图7)。PGX患者分层试验基于特定的分子特征评测/遗传标志物选择患者进行试验,随着精准医疗的发展,此类试验的数量也逐渐增加。
值得注意的是,纳入预测性生物标志物的I/II期试验数量均显著增加,自2015年以来分别增加了121%和61%。
临床试验中,多种靶向疗法均使用了预测性生物标志物,且针对PD-1/PD-L1、BRAF和EGFR进行了生物标志物检测。更多基于预测性生物标志物的新疗法也在研究中。对于成纤维细胞生长因子受体(FGFR)抑制剂,可根据FGFR基因突变或融合状态对患者分层进行使用。Erdafitinib(Balversa)在2019年被确定为首个靶向膀胱癌FGFR突变的药物(膀胱癌属于全球十大最常见的癌症之一),在其他癌症治疗的应用也在研究中。其他基于预测性生物标志物的新药物包括重新排列的转染(RET)抑制剂。
RET基因组重排或突变可抑制激酶,这将抑制癌细胞生长或缩小肿瘤。尽管少数激酶抑制剂非选择性地靶向RET蛋白(例如cabozantinib、lenvatinb和vandetanib),2020年,基于生物标记物检测,selpercatinib(Retevmo)获批为首个专门用于治疗晚期RET导致的肺癌和甲状腺癌患者的RET抑制剂。RET依赖性激酶抑制剂的进一步研究可促使依赖组织学或组织不确定类新药获得批准。
值得注意的是,包含PGX的肿瘤新药临床试验在过去五年中约占44%,之后平稳增长(见图7)。这一趋势与免疫肿瘤试验增长趋势吻合,免疫肿瘤试验数量从2013年开始大量增加,包含PGX生物标志物的试验数量也大增,但之后又恢复平稳增长。自2017年以来,检查点抑制剂试验增长趋缓,目前全球已上市9个产品。PGX试验的数量增长总体趋平,也可能是由靶向精准试验整体减少、不含PGX检测的免疫肿瘤试验增加所致。
自2010年以来,适应性试验、伞试验和篮子试验的数量翻了三倍。在2019年,6%后期管线肿瘤疗法应用了新的试验类型。基于精准生物标志物的新试验的比例也有所上升,从2010年的50%上升到了2019年的70%以上,这也表明新试验设计有助于精准治疗药物的研发。
免疫肿瘤和组织不确定类药物管线
免疫肿瘤管线
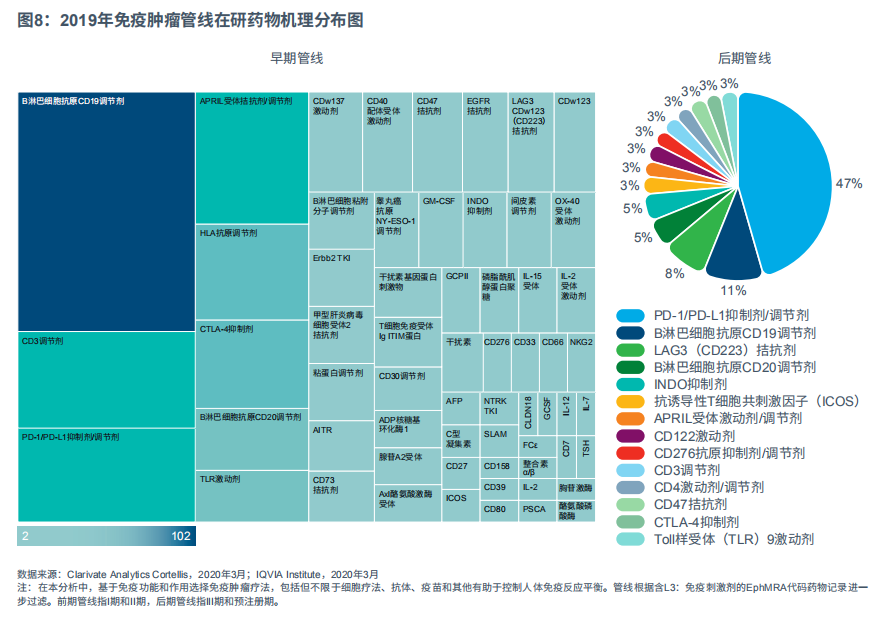
免疫肿瘤治疗正在快速发展,现如今各类型各阶段的肿瘤免疫管线超过700个。I期和II期免疫肿瘤管线涵盖了超过102种机理和675种药物。其中18%为CD19和CD20靶向药,9%为检查点抑制剂。此外,治疗新机理也层出不穷,如创新检查点抑制剂抗CD223(LAG-3)疗法,这是一个免疫肿瘤靶点,可治疗不响应PD1/PD-L1疗法的患者。
后期免疫肿瘤产品的数量自2018年增加了65%,从23个增加到38个,代表14个不同机理。PD-1/PD-L1检查点抑制剂占后期免疫肿瘤管线的47%之多。药物配方的改善或和其他靶向疗法的联合治疗,将带来前所未有的医学突破。嵌合抗原受体(CAR)产品为后期免疫肿瘤管线在研药物,包括靶向B淋巴细胞CD19抗原(CART细胞疗法靶点;在后期管线中占11%)和创新CAR-T细胞产品B淋巴细胞CD20抗原抑制剂(5%)。在后期产品中,抗CD223疗法占8%,吲哚胺-吡咯-2,3-加双氧酶(IDO/INDO)抑制剂占5%。IDO疗法尽管最初疗效显著,但在后期试验却表现不佳。
检查点抑制剂试验趋势
检查点抑制剂目前全球已上市9个产品,相关临床试验数量是2015年的2倍。约1/3的在研检查点抑制剂临床试验用于针对肺癌、淋巴癌等实体瘤的治疗。尽管检查点抑制剂的相关临床试验数量仍在增长,从2018~2019年开始,随着新型疗法的问世,如基因疗法、RET抑制剂和CAR细胞疗法,临床试验数量的增长渐趋平稳。值得注意的是,自2010年以来,一些联合免疫肿瘤疗法(包含一种以上的疗法)的临床试验在稳步增长,目前的数量是2014年的6倍。检查点抑制剂联合其他类型癌症疗法来提高疗效,将是未来的一大方向。
CAR细胞疗法
细胞和基因疗法将成为肿瘤治疗的下一轮创新浪潮。这些创新疗法将改变患者体内特定细胞的基因信息,用于治疗和预防疾病,例如CAR细胞疗法,目前已证实与某些血液肿瘤的缓解相关。
截至2020年6月,已有两种CAR-T细胞产品上市。Axicabtagene ciloleucel(Yescarta)用于治疗弥漫大B细胞淋巴瘤(DLBCL),tisagenlecleucel(Kymriah)用于治疗成人弥漫大B细胞淋巴瘤(DLBCL)和小儿B细胞急性淋巴细胞白血病,未来有望获批更多适应症。
结合检查点抑制剂,CAR-T细胞疗法改变了癌症治疗格局。CAR细胞疗法试验的总数相比2015年增加了38%,在2019年涵盖了I期至预注册的100多个药物。除了目前CAR-T细胞疗法中的CD19抗原外,研究者还针对可以靶向多种抗原的双特异性CAR-T细胞以及其他新靶点,如CD20、CD22和CD7,在研CAR产品。预注册的CAR疗法包括用于治疗多发性骨髓瘤的B细胞成熟抗原(BCMA)decabtagene vicleucel和用于治疗大B细胞淋巴瘤的抗CD19 lisocabtagene maraleucel。CAR-T细胞疗法在B细胞癌治疗中的成功,推动了恶性血液肿瘤和实体瘤新药的研发。在2019年,实体瘤仅占CAR试验的8%左右,但CAR细胞疗法却有潜力改变这些肿瘤的治疗模式。治疗实体瘤的CAR新药可能采用新方法,如“铠装T细胞”、CAR自然杀伤细胞(NK)或CAR树突细胞,将有望靶向实体瘤中发现的新抗原,而非血液肿瘤中的表面抗原。CAR疗法的研发仍面临挑战,但药企可以通过选择合适的试验点,以及与在此类个性化细胞疗法监管、安全和开发方面经验丰富的团队进行合作,简化CAR试验并加速研发过程。
新冠肺炎疫情直接影响接受CAR-T细胞治疗的患者及药企。CAR疗法试验需要特定的基础设施,由特定的人员支持患者、提取患者的免疫细胞并进行基因修饰,然后重新注入患者体内,因此需要增加额外的临床研发步骤,这会使临床试验过程更加复杂。
组织不确定类管线
组织不确定类疗法的研发将改变癌症治疗模式。2019年,治疗28个不同适应症的20种组织不确定类疗法在研中(见图10)。组织不确定类的研发重点关注实体瘤,肺癌、乳腺癌的人体组织类新药研发也在进行中,这说明药企正在并行“依赖组织学”和“组织不确定类”两种研发思路。
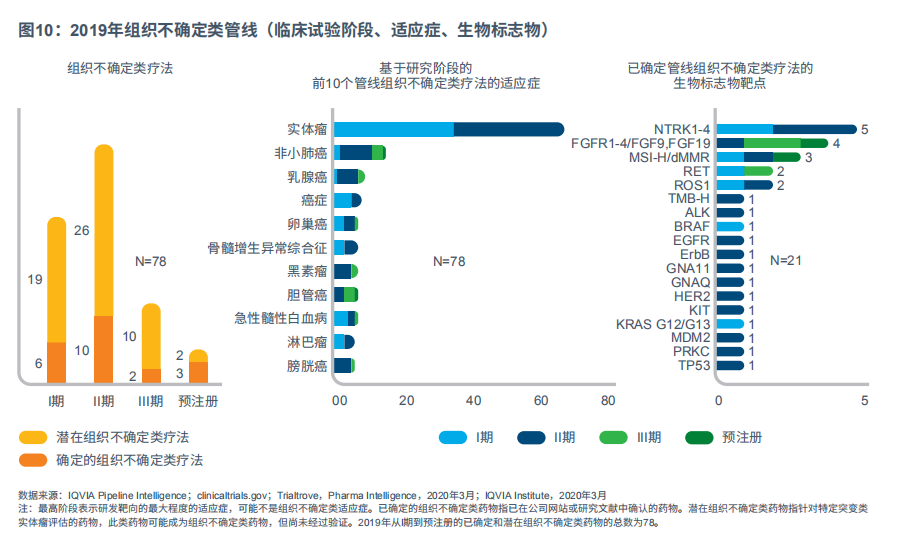
从I期至预注册期,用于组织不确定类疗法的前5个生物标志物为NTRK、FGFR、MSI-H、肿瘤突变负担(TMB)和RET基因突变。篮子试验促进了组织不确定类疗法的研发。这些试验使药企可以同时研究针对不同类型癌症的疗法,关键在于所有研究受试者具有相同的基因改变。通常来说,好比NTRK基因融合,基因组突非常少见,因此篮子试验比传统试验更有效率,可以测定多个患者亚组的疗效。例如,一项研究设定每个亚组最多10名患者(涵盖40个癌症亚型)。
这些疗法的推广和应用仍面临挑战。在常规临床治疗中,组织不确定类药物应用面临的障碍包括组织不确定的分子变异较罕见(或癌症类型较罕见),各瘤种的反应不一,监管和报销不便,以及生物标志物检测或伴随诊断的可及性不稳定。然而,随着人们对跨瘤种的共同生物标志物的进一步了解,以及更多癌症疗法证明基于预测性生物标志物检测可取得成功,组织不确定类药物的研发将持续增长势头。