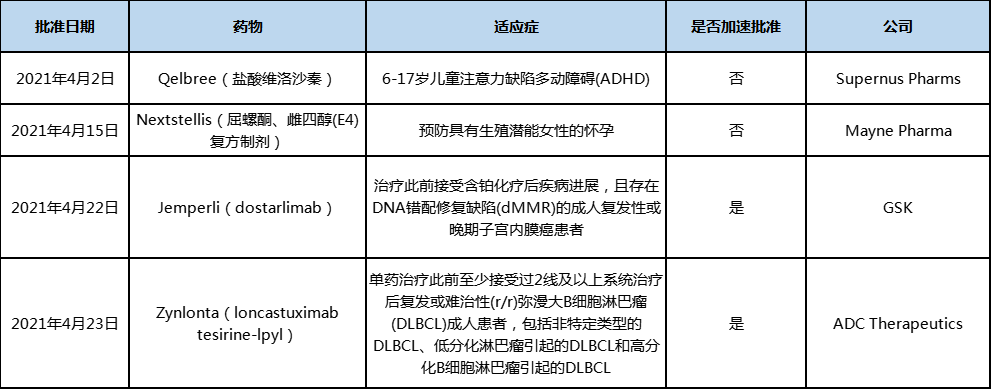
2021年4月,美国、欧盟和中国共有7款新药获批,其中Qelbree、Nextstellis、Jemperli、Zynlonta为全球首次获批。
美国
2021年4月,美国FDA批准上市4款新药,包括2款新分子实体药物、1款新的PD-1抗体、1款抗体偶联药物(ADC)。根据Pharmadigger数据库统计,这四款新药均为全球首次获批,其中两款抗肿瘤新药都是经过加速批准获批。
表1 2021年4月美国FDA批准上市的新药
注意缺陷多动症(ADHD)影响欧美市场的4000万人,包括儿童、青少年和成人。盐酸维洛沙秦(Qelbree)是一种具有选择性5-羟色胺调节活性的去甲肾上腺素再摄取抑制剂(NET),这一药物已在欧洲作为抗抑郁药物销售多年。2021年3月,美国FDA也批准了另一个用于ADHD的药物Azstarys,该药物是右哌甲酯(d-MPH)前药serdexmethylphenidate (SDX)和速释d-MPH组成的一种复方胶囊剂型。Qelbree为非激动疗法,Azstarys为激动疗法,此次Qelbree获批也成为近十年来FDA批准的首个针对ADHD的新型非刺激性疗法。该药的获批是基于在6-17岁儿童患者开展的4项III期临床试验(P301、P302、P303、P304),主要疗效终点为ADHD-RS-5评分,试验结果显示,100mg和200mg两个剂量组相对于安慰剂组均取得统计学意义改善。
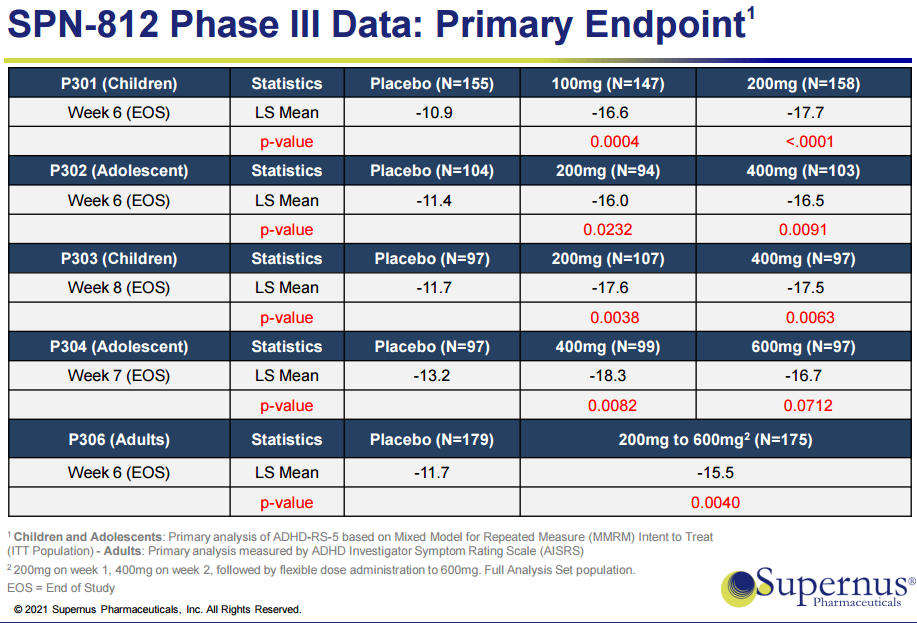
图1 Qelbree完成的III期临床试验结果
子宫内膜癌(EC)是全世界第六常见的女性癌症,形成于子宫内膜。EC可分为错配修复缺陷/微卫星不稳定性高(dMMR/MSI-H)或错配修复正常/微卫星稳定(MSI-H)。Dostarlimab是第七个上市的PD-1抗体,EC为其首个适应症,并在2021年4月实现了在美国和欧盟同步上市。

图2 GARNET研究子宫内膜癌队列的肿瘤应答率和持续时间
Dostarlimab的批准是根据名为GARNET的研究中dMMR子宫内膜癌队列的结果。该研究结果显示,71例此前接受过含铂化疗后疾病进展且存在dMMR复发或晚期子宫内膜癌患者的客观缓解率(ORR)为42.3% (95% CI; 30.6-54.6),包括12.7% 的完全缓解(CR)和29.6%的部分缓解(PR)。这些产生缓解的患者中,有93.3%的患者达到6个月或以上的缓解持续时间(DOR)。
Zynlonta是一个靶向CD19的ADC药物,偶联的毒素部分为小分子成分SG3199,是一种PBD(吡咯并苯并二氮杂卓,可识别和键合DNA特定序列)二聚物和烷基化剂。该药的批准是基于一项代号为LOTIS-2的II期临床研究结果,共有145例此前接受二线及以上系统性治疗失败的r/r DLBCL患者接受治疗,包括接受过干细胞移植和CAR-T疗法的患者。患者每3周接受0.15毫克/千克的Zynlonta治疗,共两个周期,然后每3周接受0.075毫克/千克治疗。结果显示,患者的ORR为48.3%,CR为24.8%,PR为23.4%,22例(15.2%)患者病情稳定。
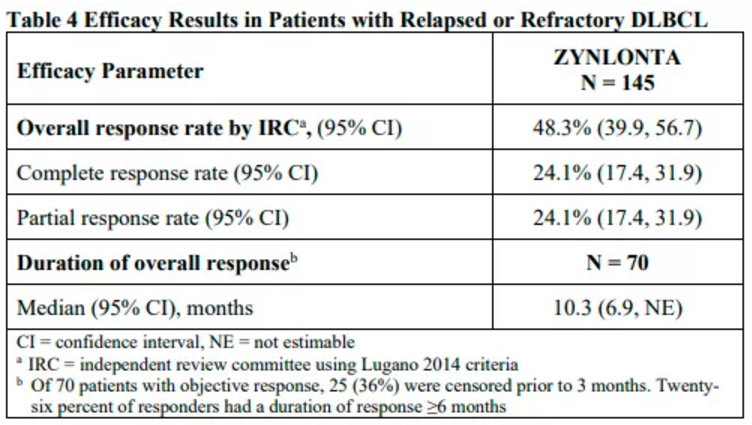
图3 LOTIS-2研究的有效性结果
欧盟
2021年4月,欧盟只批准了一款新药上市,即同样也在美国上市的Jemperli(dostarlimab)。
表2 2021年4月欧盟批准上市的新药
 中国
中国
中国在4月份批准了2款新药上市,都是已经在欧美上市、新进入我国的国外药企产品。
一款是eftrenonacog Alfa,该药是全球首个人重组凝血因子IXFc融合蛋白(简称rFIXFc),最早于2014年3月在美国上市。血友病是一种罕见的隐性遗传性出血性疾病。我国血友病患者约有3.8万人,其中15%-20%为血友病B患者。血友病B患者因体内凝血因子IX缺乏或活性较低,终生面临严重出血风险。过去,要使血友病B患者体内的凝血因子IX保持在一定水平,需要每天输注1次凝血因子;而eftrenonacog Alfa仅需每周注射一次。2019年4月,该药就已被国家药监局药品审评中心列入第二批临床急需境外新药名单。
另一款获批药物是诺和诺德的一周注射一次的GLP-1激动剂司美格鲁肽,其最早于2017年12月在美国上市。该药的获批是基于SUSTAIN系列研究,该研究共纳入11,000余名患者,其中包括605例中国患者。研究证实了司美格鲁肽的降糖疗效、安全性和心血管代谢获益。研究结果显示,在中国人群中,司美格鲁肽可显著降低糖化血红蛋白(HbA1c),最高降幅达1.8%,HbA1c达标率(<7 .0%)高达86.1%,且低血糖发生率极低。进一步分析显示,无论患者基线的hba1c处于高水平或者接近于7%,司美格鲁肽均可使平均hba1c水平降至7%以内。
表3 2021年4月中国批准上市的新药

尽管4月我国没有本土药企新药上市,但是创新抗癌药新适应症在中国获批同样非常值得关注。
4月14日,阿斯利康的EGFR靶向药物甲磺酸奥希替尼片在中国获批了第3个适应症,用于IB-IIIA期存在表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的非小细胞肺癌患者的治疗,患者须既往接受过手术切除治疗,并由医生决定接受或不接受辅助化疗。该药的获批为早期且不适合辅助化疗的肺癌患者提供了新的治疗选择。
4月29日,恒瑞医药的PD-1抗体药物卡瑞利珠单抗在中国获批第5个适应症,用于治疗既往接受过二线及以上化疗后疾病进展或不可耐受的晚期鼻咽癌患者。
同日,罗氏公司的PD-L1抗体阿替利珠单抗在中国获批第3个适应症,用于一线单药治疗PD-L1高表达,且无EGFR或ALK基因突变的转移性非小细胞肺癌。