2020年,受新冠肺炎疫情的影响,我国医药制造业营收增速下降,但国际化拓展方面却交出了一份满意的答卷。
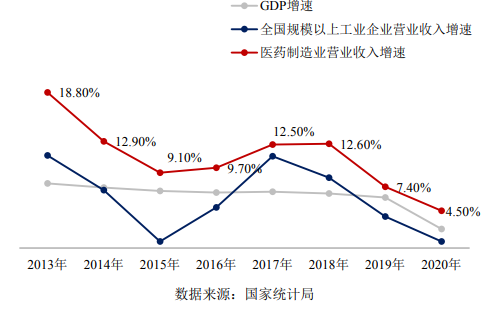
图片:国内GDP及医药制造业营收增速
license-in
近年来,国内药企对license-in青睐有加,很多药企从国外技术公司引入优质项目。比如,贝达药业与美国Agenus Inc.公司达成合作,取得在大中华区单用或联用治疗除膀胱内给药外的所有肿瘤学和非肿瘤学适应症的独家开发并商业化Balstilimab(PD-1 抗体)和Zalifrelimab(CTLA-4 抗体)的权利。齐鲁制药与美国Sesen bio公司签订授权协议,获得该公司产品vicineum的大中华区独家授权(开发及销售)。再鼎医药达成多项license-in项目:与美国Cullinan Oncolog达成合作,取得CLN-081在大中华区的开发、生产和商业化工作;与美国Turning Point Therapeutics合作,获得repotrectinib在大中华区的独家开发和商业化权利;与美国再生元公司分担部分REGN1979的全球开发费用,并获得其在大中华区的肿瘤领域开发和独家商业化权利;与美国Five Prime Therapeutics公司合作,首创靶向疗法bemarituzumab一线治疗晚期胃或胃食管连接部(GEJ)癌患者2期临床研究FIGHT取得阳性结果;与美国MacroGenics公司合作,推进MARGENZA在晚期胃癌领域的临床开发。
欧美上市
国内药企“走出去”的主要标志仍然是在国际主流医药市场上销售国产药品,尤其是美国及欧盟市场。2020年这一成果得到进一步扩大,例如,以岭药业的赖诺普利片、阿昔洛韦胶囊、伐昔洛韦片、塞来昔布胶囊,齐鲁制药的依西美坦片、哌柏西利胶囊,以及恒瑞医药的盐酸右美托咪定氯化钠注射液等,都获得了美国FDA批准上市;齐鲁安替的头孢克洛原料药获得了欧盟CEP证书。
值得一提的是,齐鲁制药的奥沙利铂注射液成为国内首个及目前唯一获得国家药监局和美国FDA双认证的参比制剂产品。
license-out
近年来,国内药企的创新水平快速高,这体现在创新项目对外授权(license-out)方面。
2020年,贝达药业授权EYPT以局部注射方式开发酪氨酸激酶抑制剂Vorolanib(CM082)治疗湿性年龄相关性黄斑变性等眼部疾病,EYPT负责新治疗方案EYP-1901的开发以及在中国(包括香港、澳门和台湾地区)以外的全球商业化,用于治疗湿性年龄相关性黄斑变性、糖尿病视网膜病变和视网膜静脉阻塞。
2020年11月10日,恒瑞医药与韩国东亚公司达成协议,以1.3927亿美元交易总额将自主研发且具有知识产权的抗肿瘤药品SHR-1701项目授权许可给韩国东亚公司,恒瑞医药同时获得韩国东亚公司的销售分成。另外,恒瑞医药还许可韩国HLB Life Science公司在韩国开发和销售其具有自主知识产权的抗肿瘤药品马来酸吡咯替尼片。
中药出海
中医药在抗击新冠肺炎疫情中的贡献,再次向全世界证明了中医药的巨大价值。中医药国际化正面临前所未有的大好局面。
2020年,以岭药业的连花清瘟胶囊不仅在国内销售火爆,更是迅速跨出国门,获得俄罗斯膳食补充剂、乌克兰膳食补充剂、乌干达植物药、毛里求斯中成药、科威特药品、吉尔吉斯斯坦食品补充剂、菲律宾药品、老挝药品、新加坡中成药、厄瓜多尔天然药物、泰国现代植物药的注册批文。2020年将是载入中药企业走向国际的里程碑式年份。
付出与风险
医药产品具有高科技、高风险、周期长的特点,尤其是创新药,前期研发投资大。药品从研制、临床试验报批到投产,容易受到不确定性因素的影响,投资收益与风险并存。
2020年国内药企对国外产品的追逐竞价热度依然:
据贝达药业发布的公告,其与美国Agenus Inc.就Balstilimab(PD-1抗体)和Zalifrelimab(CTLA-4抗体)达成的合作,首笔资金交易高达3500万美元。
再来看看再鼎医药:2020年7月,再鼎医药与Turning Point Therapeutics达成协议,推进Turning Point的主要候选药物repotrectinib在大中华区的开发及商业化。再鼎医药支付美国Turning Point Therapeutics现金预付款2500万美元,后者仍可获得最高至1.51亿美元的潜在开发、注册和基于销售的里程碑付款,以及额外的特许权使用费;2020年12月,再鼎医药和Cullinan Oncology达成独家授权合作,以推进CLN-081在大中华区的开发、生产和商业化工作。Cullinan Oncology旗下子公司Cullinan Pearl将获得2,000万美元的预付款,并有资格获得最高至2.11亿美元的开发、注册和基于销售的里程碑付款;2020年4月,再鼎医药与美国再生元就一款CD20xCD3双特异性抗体REGN1979达成战略合作,再生元将获得3000万美元的首付款,并可获得最高1.6亿美元的注册及销售里程碑付款,以及产品商业化后的部分收益。
投资有风险,新药投资尤需谨慎。2020年,恒瑞医药与日本Oncolys公司终止合作,恒瑞在完成前期研究的基础上,仍无法继续拥有溶瘤腺病毒产品TelomelysinTM(OBP-301)在中国的临床开发、生产及商业化的的独家许可权。