A:生物制品已经在临床上开始广泛应用,占药品市场的份额也越来越大。但由于生物制品是由活的生物体产生的蛋白质或多肽等,就不可避免地存在着病毒污染的风险。ICHQ5A针对生物制品进行病毒安全性评价做了详细的规定,Q5A都有哪几块内容?
B:ICHQ5A主要介绍了4部分内容,分别是控制生物制品病毒污染的总原则、潜在的病毒污染源、如何进行病毒测试以及如何对采取的病毒清除工艺进行评价和鉴定。
A:第一部分,控制生物制品病毒污染的总原则是什么?
B:对于控制生物制品的潜在病毒污染,可归纳为以下三条相互补充的原则:一是选择并对选定的细胞系和其他原料进行检定,确保其不含可能对人有感染和(或)致病作用的病毒;二是评估生产工艺清除感染性病毒的能力;三是检测生产适当步骤的产品,确保产品未受感染性病毒的污染。因此,有关这些产品的病毒安全性,不仅要对原料和产品进行病毒测试,还要在生产过程中对病毒的清除或灭活作用进行评估,才可能得到确实的保证。
A:第二部分,对于生物制品来说可能的病毒污染源都有哪些?
B:污染可来自原细胞系本身,也可来自生产过程中偶然带入的外源病毒。具体来讲,一是来自于主细胞库(MCB)。污染主细胞库的可能途径有:
从受感染动物制备的细胞系;使用病毒建立细胞系;使用受污染的生物试剂,如动物血清组分d细胞操作过程中受到污染等。二是来自生产过程中偶然带入的外源病毒。可能的途径有:使用受污染的生物试剂,如动物血清组分;用病毒作为载体表达某一编码蛋白的特异基因;使用受污染的试剂(如单克隆抗体亲和柱);组方中使用了受污染的赋形剂;细胞和培养基操作过程受到污染等。
A:第三部分,如何进行病毒测试。首先什么是病毒测试?
B:病毒测试就是对生物制品中是否存在病毒污染以及存在哪种病毒进行检测和鉴定。有效的病毒测试方法是确定细胞系是否适用于生物制品生产的重要部分。
A:病毒测试方法有哪些?
B:病毒测试方法有很多,包括体外检测法、体内检测法、抗体产生试验、逆转录病毒测试等。
(1)体外检测法将被测试样品接种到多种敏感的细胞培养物中,观察培养物被感染的情况。测试中所用指示细胞需要根据待试细胞库的物种来源而定,但必须包括一种对人病毒敏感的人或非人灵长目动物细胞系。
(2)体内检测法将被测样品接种到哺乳期小鼠和成年小鼠以及鸡胚中,以检测细胞培养物中不能生长的病毒。
(3)抗体产生试验对于啮齿类动物细胞系中的物种特异性病毒的检测,可将被测试样品接种到无病毒的动物中去,经一段特定时间后测定其血清抗体水平或酶活性。这种试验包括:小鼠抗体产生试验(MAP)、大鼠抗体产生试验(RAP)和仓鼠抗体产生试验(HAP)。
(4)逆转录病毒测试主要针对MCB和培养达到或超过细胞传代限次的体外细胞。逆转录病毒测试包括对敏感细胞培养的感染性测定和电镜检查(EM)。如果没有检测到病毒感染,电镜检查没有发现逆转录病毒或逆转录病毒样颗粒,应再测定反转录酶(RT),或采用其他适当的方法,以确定有无非感染性的逆转录病毒。
A:这几种病毒测试方法应该如何应用?如何确保这些测试方法的有效性?
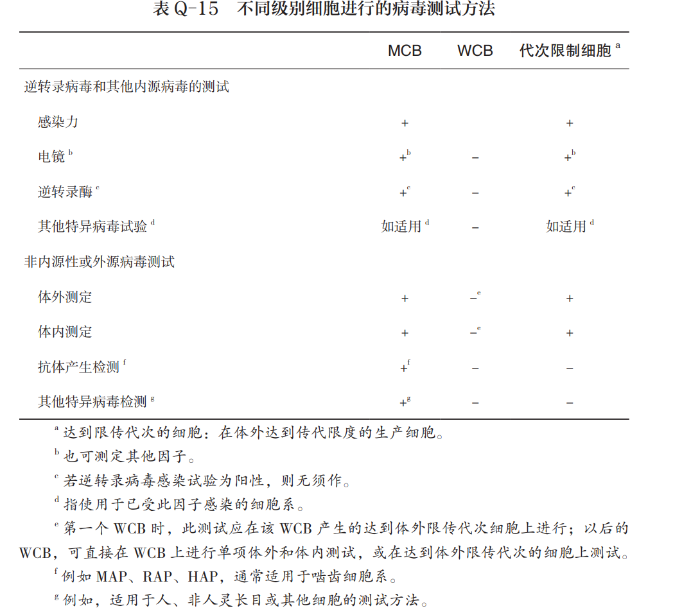
B:确保病毒测试方法的有效性就要为不同细胞有针对性地选择适合的测试方法。Q5A指导原则中对不同种类的细胞系分别应该进行哪些项目的检测进行了详细说明,见表Q-15。比如:对于主细胞库,应进行内源性和非内源性病毒污染的全面筛查;非内源性病毒的测定应包括体内和体外接种试验,并根据该细胞系的传代史进行其他特异性试验,如小鼠抗体产生试验;对于工作细胞库(WCB),必须进行外源病毒检测,一般不须作抗体产生试验;对于达到体外细胞传代限次的细胞,应进行内源性病毒检测,因为有些内源性病毒可能在MCB和WCB阶段没有被检测出,所以应对达到体外细胞传代限次的细胞进行内源性病毒检测。
A:在病毒检测和鉴别试验中有哪些注意事项?
B:为了确保试验的合理性和有效性,指导原则中给出了以下三点建议。
(1)应设相应的对照试验,以确保试验具有充分的敏感性和特异性。
(2)细胞的种系提示有较大可能存在某种病毒时,需进行专门试验和处理。如供生产用的细胞为人或非人灵长目细胞系,还应进行如引起免疫缺陷性疾病和肝炎的人源病毒测试。
(3)聚合酶链式反应(PCR)可用于检测这些人源病毒和其他特殊病毒的核酸序列。
A:第四部分,如何对采取的病毒清除工艺进行评价和鉴定?
B:病毒清除研究需要评价各个工艺步骤对清除/灭活病毒的有效性,并对病毒的整体降低水平做出定量评估。具体做法是有目的地将一定量的病毒加入到原料和各工艺步骤的抽样样本中去,通过研究在后续工艺步骤样本中的病毒量来验证该工艺步骤对病毒清除/灭活的效果。应该注意的是,通过清除病毒颗粒和使病毒灭活都可以达到降低病毒感染性的目的,所以在评定每一生产工艺步骤时,应该说明使病毒失去感染性的机制究竟是被清除还是被灭活。
A:既然要进行定量评估,那么有哪些定量指标?
B:定量指标主要是病毒清除率,一般用下降因子来表示。将纯化前与纯化后样本中病毒量之比,再取以10为底的对数,就得到了下降因子,一般用log表示。整个生产过程的总下降因子是各个阶段下降因子的对数和。病毒灭活不是一个简单的一级反应,通常比较复杂,包含有快的“一期”反应和慢的“二期”反应。因此,要在不同的时间点取样研究并建立灭活曲线。如果由于灭活太快,无法建立灭活曲线,应进行相应的对照试验以证实病毒经灭活处理已失去感染性。
A:在病毒清除研究中,如何选择加入的病毒样本?
B:病毒清除研究中的一个主要问题是确定使用何种病毒,总的原则是供清除评价和工艺鉴定研究用的病毒应与可能污染产品的病毒相似,而且要有广泛的理化特性。这些病毒可分为三类,分别是:非特异“模型”病毒、特异“模型”病毒和“相关”病毒。非特异“模型”病毒是用来为生产工艺清除/灭活病毒的总体能力进行定性,即确定方法的可靠性的病毒。特异“模型”病毒是与已知病毒或可疑病毒密切相关(同种或同属),并与所观察到的或可疑的病毒具有类似理化特性的病毒。“相关”病毒是指用于生产过程中评价病毒清除情况的病毒,可以是已被鉴定的病毒,或是与已知病毒种类相同的病毒,或是可能会污染细胞培养物或污染生产过程中使用的其他试剂和材料的病毒。病毒选择的具体要求大家可以详细阅读指导原则。
A:在病毒清除研究中有哪些注意事项?
B:指导原则中特别指出了病毒清除研究中的几点注意事项。
(1)制备高滴度病毒时应注意避免凝集反应,因为它可增强物理清除作用,降低灭活作用,从而与实际生产不符。
(2)需要注意任何一种分析方法都有其最低检出病毒量。
(3)应进行平行对照试验,以评估样品是否在检测病毒滴度前因稀释、浓缩、过滤或贮存等原因使病毒失去感染性。
(4)加入产品中的病毒量要小,否则会使产品稀释或改变性质而与生产规模的产品不同。
(5)诸如缓冲液、培养基、色谱柱、操作时间等的微小不同都会影响病毒的清除效果。或者有些缓冲剂和产品本身具有细胞毒性或抗病毒的活性,这时应分别对缓冲剂和产品评估其对病毒滴度检测的干扰。
(6)病毒灭活是时间依赖性的。因此,加入病毒的产品在某一缓冲剂中或特定色谱分离柱中停留的时间长短应能反映生产规模的工艺条件。
(7)应分别对缓冲剂和产品评估其毒性或对病毒滴度检测方法的干扰,因为这些因素会对指示细胞产生不良影响。
(8)许多纯化方案中都反复使用相同或相似的缓冲液或分离柱。分析数据时,应考虑这种方法带来的影响。某一特定工艺的消除病毒效果会随所在的生产阶段而有所不同。
(9)当生产条件或缓冲剂具有很强细胞毒性或灭活病毒的作用时,可能会低估总体下降因子,因此需逐例讨论。由于病毒清除研究本身的局限性或因设计不够完善,也会高估总体下降因子。另外,病毒清除工艺研究虽然有助于保证最终产品达到可接受的安全水平,但它也有一定的局限性,比如:组织培养的病毒与天然病毒具有一些特性差异;病毒对灭活产生耐受性;研究规模与实际生产规模有较大差异等。